ບົດບາດຂອງທາດໂປຼຕີນໃນຮ່າງກາຍຂອງມະນຸດ

ຄວາມ ສຳ ຄັນທີ່ຍິ່ງໃຫຍ່ຂອງໂປຣຕີນ ສຳ ລັບຮ່າງກາຍແມ່ນຍ້ອນ ໜ້າ ທີ່ຂອງມັນ.
ໜ້າ ທີ່ພື້ນຖານຂອງໂປຣຕີນທີ່ ນຳ ສະ ເໜີ ສະແດງໃຫ້ເຫັນເຖິງຄວາມ ສຳ ຄັນຂອງສານປະເພດນີ້ໃນການຮັບປະກັນຊີວິດມະນຸດປົກກະຕິ.
ໃນສະຕະວັດທີ 19, ນັກວິທະຍາສາດກ່າວວ່າ:
- ທາດໂປຼຕີນໃນຮ່າງກາຍແມ່ນເປັນເອກະລັກ, ໂດຍເນື້ອແທ້ແລ້ວຂອງຊີວິດ,
- ເປັນສິ່ງທີ່ ຈຳ ເປັນຕໍ່ການເຜົາຜານລະຫວ່າງສິ່ງມີຊີວິດແລະສິ່ງແວດລ້ອມ.
ຂໍ້ ກຳ ນົດເຫຼົ່ານີ້ຍັງບໍ່ປ່ຽນແປງຈົນເຖິງປະຈຸບັນ.
ສ່ວນປະກອບພື້ນຖານຂອງໂປຣຕີນ
ຫົວ ໜ່ວຍ ໂມເລກຸນຂະ ໜາດ ໃຫຍ່ຂອງທາດໂປຼຕີນງ່າຍໆທີ່ເອີ້ນວ່າທາດໂປຼຕີນແມ່ນຖືກສ້າງຕັ້ງຂື້ນໂດຍທ່ອນນ້ອຍໆທີ່ເຊື່ອມຕໍ່ທາງເຄມີ - ກົດອາມີໂນທີ່ມີຊິ້ນສ່ວນທີ່ຄ້າຍຄືກັນແລະແຕກຕ່າງກັນ. ອົງປະກອບຂອງໂຄງສ້າງດັ່ງກ່າວຖືກເອີ້ນວ່າ heteropolymers. ມີພຽງແຕ່ 20 ຕົວແທນຂອງຊັ້ນຮຽນຂອງກົດອະມິໂນເທົ່ານັ້ນທີ່ພົບໃນໂປຣຕີນ ທຳ ມະຊາດ. ສ່ວນປະກອບພື້ນຖານຂອງທາດໂປຼຕີນແມ່ນມີລັກສະນະໂດຍການ ຈຳ ເປັນຂອງຄາບອນ - C, ໄນໂຕຣເຈນ - N, ໄຮໂດເຈນ - H, ອົກຊີເຈນ - O. ຊູນຟູຣິກ - S ມັກພົບໃນທາດໂປຼຕີນທີ່ສັບສົນທີ່ເອີ້ນວ່າໂປຣຕີນ, ສານປະກອບອື່ນໆມີຢູ່ນອກ ເໜືອ ຈາກທາດອາຊິດ amino. ເພາະສະນັ້ນ, phosphorus - P, ທອງແດງ - Cu, ທາດເຫຼັກ - Fe, ທາດໄອໂອດິນ - I, selenium - Se ສາມາດຢູ່ໃນສ່ວນປະກອບຂອງພວກມັນ.
ອາຊິດ Aminocarboxylic ຂອງທາດໂປຼຕີນຈາກ ທຳ ມະຊາດຖືກຈັດປະເພດຕາມໂຄງສ້າງທາງເຄມີແລະຄວາມ ສຳ ຄັນທາງຊີວະພາບ. ການຈັດປະເພດເຄມີແມ່ນມີຄວາມ ສຳ ຄັນຕໍ່ນັກເຄມີ, ຊີວະສາດ - ສຳ ລັບທຸກໆຄົນ.
ຢູ່ໃນຮ່າງກາຍຂອງມະນຸດແມ່ນມີສອງສາຍນ້ ຳ ທີ່ປ່ຽນແປງໄປເລື້ອຍໆ:
- ການແຕກແຍກ, ການຜຸພັງ, ການ ກຳ ຈັດຜະລິດຕະພັນອາຫານ,
- ການສັງເຄາະທາງຊີວະພາບຂອງສານທີ່ ສຳ ຄັນ ໃໝ່.
ອາຊິດ amino 12 ຈາກພົບໃນໂປຣຕີນ ທຳ ມະຊາດສະເຫມີສາມາດສ້າງຂື້ນໂດຍການສັງເຄາະທາງຊີວະພາບຂອງຮ່າງກາຍມະນຸດ. ພວກມັນຖືກເອີ້ນວ່າແລກປ່ຽນກັນໄດ້.
ກົດອະມິໂນ 8 ຊະນິດບໍ່ເຄີຍສັງເຄາະຢູ່ໃນມະນຸດ. ພວກມັນແມ່ນສິ່ງທີ່ຂາດບໍ່ໄດ້, ຄວນໄດ້ຮັບອາຫານເປັນປະ ຈຳ.
ອີງຕາມການມີກົດອາມີ amino-carboxylic ທີ່ ຈຳ ເປັນ, ທາດໂປຼຕີນຖືກແບ່ງອອກເປັນສອງຊັ້ນ.
- ທາດໂປຼຕີນທີ່ສົມບູນມີອາຊິດ amino ທັງຫມົດທີ່ຮ່າງກາຍຂອງມະນຸດຕ້ອງການ. ອາຊິດ amino ທີ່ ຈຳ ເປັນທີ່ ກຳ ນົດໄວ້ມີທາດໂປຼຕີນຈາກເນີຍແຂງໃນບ້ານ, ຜະລິດຕະພັນນົມ, ສັດປີກ, ຊີ້ນສັດ, ທະເລແລະປານ້ ຳ ຈືດ, ໄຂ່.
- ໃນໂປຣຕີນທີ່ຂາດຕົກບົກຜ່ອງ, ອາຊິດທີ່ ສຳ ຄັນ ໜຶ່ງ ຫຼືຫຼາຍຊະນິດອາດຈະຂາດ. ເຫຼົ່ານີ້ລວມມີທາດໂປຣຕີນຈາກພືດ.
ເພື່ອປະເມີນຄຸນນະພາບຂອງໂປຣຕີນອາຫານ, ຊຸມຊົນໃນໂລກດ້ານການແພດປຽບທຽບພວກມັນກັບທາດໂປຼຕີນທີ່“ ເໝາະ ສົມ”, ເຊິ່ງໄດ້ກວດສອບອັດຕາສ່ວນຂອງອາຊິດ amino ທີ່ ຈຳ ເປັນແລະ ຈຳ ເປັນຢ່າງເຂັ້ມງວດ. ໃນ ທຳ ມະຊາດ, ທາດໂປຼຕີນ“ ດີເລີດ” ບໍ່ມີ. ເປັນຄົນໃກ້ຊິດກັບລາວທີ່ເປັນໂປຣຕີນຂອງສັດ. ທາດໂປຼຕີນຈາກພືດມັກຈະບໍ່ພຽງພໍກັບຄວາມເຂັ້ມຂົ້ນທີ່ປົກກະຕິຂອງອາຊິດ amino ຫນຶ່ງຫຼືຫຼາຍ. ຖ້າມີສານເພີ່ມເຕີມທີ່ຂາດຫາຍໄປ, ທາດໂປຼຕີນຈະກາຍເປັນທີ່ສົມບູນ.
ແຫຼ່ງຕົ້ນຕໍຂອງທາດໂປຼຕີນຈາກຕົ້ນ ກຳ ເນີດຂອງພືດແລະສັດ
ໃນຊຸມຊົນວິທະຍາສາດພາຍໃນປະເທດເຂົ້າຮ່ວມໃນການສຶກສາຄົ້ນຄວ້າກ່ຽວກັບເຄມີສາດດ້ານອາຫານ, ກຸ່ມອາຈານ A.P. Nechaev, ເພື່ອນຮ່ວມງານ, ແລະນັກຮຽນໂດດເດັ່ນ. ທີມງານໄດ້ ກຳ ນົດເນື້ອໃນຂອງທາດໂປຼຕີນໃນຜະລິດຕະພັນອາຫານຫລັກທີ່ມີຢູ່ໃນຕະຫລາດຣັດເຊຍ.
- ທີ່ ສຳ ຄັນ! ຕົວເລກທີ່ໄດ້ຮັບການແຈ້ງໃຫ້ຊາບກ່ຽວກັບເນື້ອໃນຂອງທາດໂປຼຕີນໃນ 100 g ຂອງຜະລິດຕະພັນ, ໄດ້ຮັບການປົດປ່ອຍຈາກສ່ວນທີ່ບໍ່ມີປະໂຫຍດ.
- ປະລິມານທາດໂປຼຕີນຫຼາຍທີ່ສຸດແມ່ນພົບໃນຖົ່ວເຫຼືອງ, ແກ່ນຜັກແລະຖົ່ວດິນ (34.9 - 26.3 g).
- ຄຸນຄ່າຈາກ 20 ຫາ 30 ກຣາມແມ່ນພົບຢູ່ໃນເມັດຖົ່ວ, ຖົ່ວ, ໝາກ ນັດ, ແລະແກ່ນດອກຕາເວັນ.
- ໝາກ ອະງຸ່ນ, ໝາກ ມ່ວງຫິມະພານ, hazelnuts ແມ່ນມີຕົວເລກຈາກ 15 ເຖິງ 20 gr.
- Walnuts, pasta, ຫານປະເພດເມັດສ່ວນໃຫຍ່ (ຍົກເວັ້ນເຂົ້າ, ເມັດພືດສາລີ) ບັນຈຸໂປຕີນຈາກ 10 ຫາ 15 ກຣາມຕໍ່ 100 ກຼາມຂອງຜະລິດຕະພັນ.
- ເຂົ້າ, ເຂົ້າສາລີ, ເຂົ້າຈີ່, ຜັກທຽມ, apricots ແຫ້ງແມ່ນຢູ່ໃນລະດັບແຕ່ 5 ເຖິງ 10 gr.
- ໃນກະລໍ່າປີ 100 ກຼາມ, ເຫັດ, ມັນຝະລັ່ງ, prunes, ບາງແນວພັນ beet, ເນື້ອໃນຂອງທາດໂປຼຕີນຈາກ 2 ຫາ 5 ກຼາມ.
- ດອກກຸຫລາບ, radishes, carrots, peppers ຫວານມີທາດໂປຼຕີນພຽງເລັກນ້ອຍ, ຕົວຊີ້ວັດຂອງພວກເຂົາບໍ່ເກີນ 2 ກຼາມ.
ຖ້າທ່ານບໍ່ສາມາດຊອກຫາວັດຖຸພືດຢູ່ທີ່ນີ້, ຫຼັງຈາກນັ້ນຄວາມເຂັ້ມຂົ້ນຂອງທາດໂປຼຕີນໃນມັນຍັງຕໍ່າໂພດຫລືມັນບໍ່ມີເລີຍ. ຍົກຕົວຢ່າງ, ໃນນ້ ຳ ໝາກ ໄມ້ມີທາດໂປຼຕີນ ໜ້ອຍ ຫຼາຍ, ໃນນ້ ຳ ມັນຜັກ ທຳ ມະຊາດ - ບໍ່ແມ່ນຫຍັງເລີຍ.
- ຄວາມເຂັ້ມຂົ້ນຂອງທາດໂປຼຕີນສູງສຸດແມ່ນພົບໃນເຕົາປາ, ຊີດແຂງແລະປຸງແຕ່ງ, ແລະຊີ້ນກະຕ່າຍ (ຈາກ 21,1 ເຖິງ 28,9 g).
- ຜະລິດຕະພັນ ຈຳ ນວນຫລວງຫລາຍບັນຈຸໂປຕີນຈາກ 15 ຫາ 10 ກຣາມ. ນີ້ແມ່ນນົກ, ປາທະເລ (ຍົກເວັ້ນ capelin), ຊີ້ນງົວ, ກຸ້ງ, ປາຫມຶກ, ເນີຍແຂງ cottage, ເນີຍແຂງ feta, ປານ້ ຳ ຈືດ.
- Capelin, ໄຂ່ໄກ່, ຊີ້ນ ໝູ ບັນຈຸໂປຕີນ 12.7 ເຖິງ 15 ກຣາມຕໍ່ 100 ກຼາມຂອງຜະລິດຕະພັນ.
- ນົມສົ້ມ, ເນີຍແຂງ curd ແມ່ນສະແດງໂດຍຕົວເລກ 5 - 7.1 gr.
- ນົມ, kefir, ນົມທີ່ ໝັກ ຜ່ານການປຸງແຕ່ງ, ຄີມສົ້ມ, ຄີມມີໂປຕີນຈາກ 2,8 ຫາ 3 ກຣາມ.
ຂໍ້ມູນກ່ຽວກັບແຫຼ່ງຕົ້ນຕໍຂອງທາດໂປຼຕີນຈາກຕົ້ນ ກຳ ເນີດຂອງພືດແລະສັດໃນຜະລິດຕະພັນທີ່ຜ່ານການປຸງແຕ່ງເຕັກໂນໂລຢີຫຼາຍຂັ້ນຕອນ (ເຕົາ, ໄສ້, ຊີ້ນ ໝູ, ໄສ້ກອກ) ບໍ່ມີຄວາມສົນໃຈ. ພວກມັນບໍ່ໄດ້ຖືກແນະ ນຳ ໃຫ້ກິນອາຫານເພື່ອສຸຂະພາບເປັນປະ ຈຳ. ການ ນຳ ໃຊ້ຜະລິດຕະພັນດັ່ງກ່າວໃນໄລຍະສັ້ນແມ່ນບໍ່ມີຄວາມ ໝາຍ ຫຍັງ.
ບົດບາດຂອງທາດໂປຼຕີນໃນໂພຊະນາການ
ເປັນຜົນມາຈາກຂະບວນການທາງເດີນອາຫານຢູ່ໃນຮ່າງກາຍ, ໂມເລກຸນທາດໂປຼຕີນ ໃໝ່ ຖືກສ້າງຕັ້ງຂື້ນເລື້ອຍໆ, ແທນທີ່ຈະເປັນຂອງເກົ່າ. ອັດຕາການສັງເຄາະໃນອະໄວຍະວະຕ່າງກັນບໍ່ຄືກັນ. ທາດໂປຼຕີນຈາກຮໍໂມນ, ຍົກຕົວຢ່າງ, ອິນຊູລິນ, ໄດ້ຮັບການຟື້ນຟູ (ປັບຂະ ໜາດ) ຢ່າງໄວວາ, ໃນຊົ່ວໂມງ, ນາທີ. ທາດໂປຼຕີນຈາກຕັບ, ເຍື່ອເມືອກໃນ ລຳ ໄສ້ໄດ້ຖືກຟື້ນຟູຄືນ ໃໝ່ ພາຍໃນ 10 ວັນ. ໂມເລກຸນທາດໂປຼຕີນຂອງສະ ໝອງ, ກ້າມເນື້ອ, ເນື້ອເຍື່ອເຊື່ອມຕໍ່ໄດ້ຮັບການຟື້ນຟູທີ່ຍາວທີ່ສຸດ, ການສັງເຄາະການຟື້ນຟູ (ການຍືດເຍື້ອ) ສາມາດມີໄດ້ເຖິງ 6 ເດືອນ.
ຂະບວນການຂອງການ ນຳ ໃຊ້ແລະການສັງເຄາະແມ່ນມີຄວາມສົມດຸນໂດຍຄວາມສົມດຸນຂອງໄນໂຕຣເຈນ.
- ໃນຄົນທີ່ຖືກສ້າງຕັ້ງຂື້ນມີສຸຂະພາບດີ, ຄວາມສົມດຸນຂອງໄນໂຕຣເຈນແມ່ນສູນ. ໃນກໍລະນີນີ້, ມວນສານໄນໂຕຣເຈນທັງ ໝົດ ທີ່ສະ ໜອງ ທາດໂປຼຕີນໃນລະຫວ່າງການໂພຊະນາການແມ່ນເທົ່າກັບມວນສານທີ່ອອກຈາກຜະລິດຕະພັນເນົ່າເປື່ອຍ.
- ອົງການຈັດຕັ້ງ ໜຸ່ມ ກຳ ລັງພັດທະນາຢ່າງໄວວາ. ຄວາມສົມດຸນຂອງໄນໂຕຣເຈນແມ່ນໃນທາງບວກ. ມີທາດໂປຼຕີນຫຼາຍ, ໜ້ອຍ ກໍ່ຈະຖືກປ່ອຍອອກມາ.
- ໃນຜູ້ສູງອາຍຸ, ຄົນປ່ວຍ, ຄວາມດຸ່ນດ່ຽງຂອງໄນໂຕຣເຈນແມ່ນກະທົບທາງລົບ. ມວນສານໄນໂຕຣເຈນທີ່ປ່ອຍອອກມາດ້ວຍຜະລິດຕະພັນການເຜົາຜານແມ່ນໃຫຍ່ກ່ວາທີ່ໄດ້ຮັບຈາກການຮັບປະທານອາຫານ.
ບົດບາດຂອງທາດໂປຼຕີນໃນໂພຊະນາການແມ່ນເພື່ອໃຫ້ບຸກຄົນທີ່ມີສ່ວນປະກອບອາຊິດ amino ທີ່ ຈຳ ເປັນ ເໝາະ ສົມ ສຳ ລັບການມີສ່ວນຮ່ວມໃນຂະບວນການທາງຊີວະເຄມີຂອງຮ່າງກາຍ.
ເພື່ອຮັບປະກັນການເຜົາຜານອາຫານແບບ ທຳ ມະດາ, ມັນ ຈຳ ເປັນທີ່ຈະຕ້ອງຮູ້ວ່າຄົນເຮົາຕ້ອງການທາດໂປຼຕີນຫຼາຍປານໃດຕໍ່ມື້.
ນັກ ບຳ ບັດທາງດ້ານຮ່າງກາຍພາຍໃນແລະອາເມລິກາແນະ ນຳ ໃຫ້ກິນໂປຣຕີນ 0,8 - 1 ກຣາມຕໍ່ນ້ ຳ ໜັກ ຄົນ 1 ກິໂລ. ຕົວເລກແມ່ນຂ້ອນຂ້າງສະເລ່ຍ. ຈຳ ນວນເງິນແມ່ນຂື້ນກັບອາຍຸ, ລັກສະນະການເຮັດວຽກ, ວິຖີຊີວິດຂອງບຸກຄົນ. ໂດຍສະເລ່ຍແລ້ວ, ພວກເຂົາແນະ ນຳ ໃຫ້ບໍລິໂພກໂປຼຕີນຈາກ 60 ກຣາມເຖິງ 100 ກຣາມຕໍ່ມື້. ສຳ ລັບຜູ້ຊາຍທີ່ເຮັດວຽກທາງດ້ານຮ່າງກາຍ, ມາດຕະຖານສາມາດເພີ່ມຂື້ນເປັນ 120 ກຣາມຕໍ່ມື້. ສຳ ລັບຜູ້ທີ່ ກຳ ລັງຜ່າຕັດ, ພະຍາດຕິດຕໍ່, ມາດຕະຖານຍັງເພີ່ມຂື້ນເປັນ 140 ກຣາມຕໍ່ມື້. ຜູ້ທີ່ເປັນໂລກເບົາຫວານແມ່ນແນະ ນຳ ກ່ຽວກັບອາຫານທີ່ມີເນື້ອໃນສູງຂອງຜະລິດຕະພັນໂປຕີນ, ເຊິ່ງສາມາດບັນລຸ 140g ຕໍ່ມື້. ຄົນທີ່ເປັນໂຣກຜິດປົກກະຕິກ່ຽວກັບການຍ່ອຍອາຫານ, ມັກເປັນພະຍາດ gout, ຄວນບໍລິໂພກທາດໂປຼຕີນ ໜ້ອຍ ລົງ. ມາດຕະຖານ ສຳ ລັບພວກມັນແມ່ນ 20 - 40 ກຣາມຕໍ່ມື້.
ສຳ ລັບຜູ້ທີ່ມີສ່ວນຮ່ວມໃນກິລາທີ່ມີການເຄື່ອນໄຫວທີ່ເຮັດໃຫ້ມວນກ້າມເນື້ອເພີ່ມຂື້ນ, ມາດຕະຖານເພີ່ມຂື້ນຢ່າງຫຼວງຫຼາຍ, ສາມາດບັນລຸ 1,6-1,8 ກຼາມຕໍ່ 1 ກິໂລຂອງນ້ ຳ ໜັກ ຂອງນັກກິລາ.
- ທີ່ ສຳ ຄັນ! ມັນຄວນແນະ ນຳ ໃຫ້ຄູຝຶກຊີ້ແຈງ ຄຳ ຕອບຕໍ່ ຄຳ ຖາມ - ຄວນໃຫ້ກິນໂປຣຕີນ ຈຳ ນວນເທົ່າໃດຕໍ່ມື້ໃນເວລາອອກ ກຳ ລັງກາຍ. ຜູ້ຊ່ຽວຊານມີຂໍ້ມູນກ່ຽວກັບຄ່າໃຊ້ຈ່າຍດ້ານພະລັງງານ ສຳ ລັບການຝຶກອົບຮົມທຸກປະເພດ, ວິທີການຕ່າງໆເພື່ອຮັກສາການເຮັດວຽກປົກກະຕິຂອງຮ່າງກາຍຂອງນັກກິລາ.
ສຳ ລັບການຈັດຕັ້ງປະຕິບັດ ໜ້າ ທີ່ການວິທະຍາສາດທັງ ໝົດ, ມັນມີຄວາມ ສຳ ຄັນບໍ່ພຽງແຕ່ມີກົດອະມິໂນທີ່ ສຳ ຄັນໃນທາດໂປຼຕີນ, ແຕ່ມັນຍັງມີປະສິດທິພາບຂອງການສົມມຸດຕິຖານຂອງມັນ ນຳ ອີກ. ໂມເລກຸນທາດໂປຼຕີນມີລະດັບອົງການຈັດຕັ້ງທີ່ແຕກຕ່າງກັນ, ການລະລາຍ, ລະດັບຂອງການເຂົ້າເຖິງ enzymes ກ່ຽວກັບເຄື່ອງຍ່ອຍ. ທາດໂປຼຕີນຈາກນົມ 96%, ໄຂ່ແມ່ນແຕກແຍກຢ່າງມີປະສິດຕິຜົນ. ໃນຊີ້ນ, ປາ, 93-95% ຂອງໂປຣຕີນຖືກຍ່ອຍໄດ້ຢ່າງປອດໄພ. ຂໍ້ຍົກເວັ້ນແມ່ນທາດໂປຼຕີນຂອງຜິວຫນັງແລະຜົມ. ຜະລິດຕະພັນທີ່ມີທາດໂປຼຕີນຈາກຜັກຖືກຍ່ອຍໂດຍ 60-80%. ໃນຜັກ, 80% ຂອງທາດໂປຼຕີນຖືກດູດຊືມ, ໃນມັນຕົ້ນ - 70%, ໃນເຂົ້າຈີ່ - 62-86%.
ສ່ວນທີ່ແນະ ນຳ ຂອງໂປຣຕີນຈາກແຫຼ່ງສັດຄວນຈະເປັນ 55% ຂອງ ຈຳ ນວນໂປຼຕີນທັງ ໝົດ.
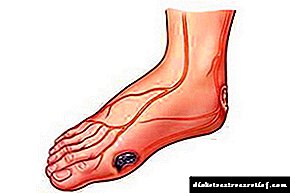
- ການຂາດທາດໂປຼຕີນໃນຮ່າງກາຍເຮັດໃຫ້ມີການປ່ຽນແປງທາງເດີນອາຫານທີ່ສໍາຄັນ. ພະຍາດດັ່ງກ່າວເອີ້ນວ່າ dystrophy, kwashiorkor. ເປັນຄັ້ງ ທຳ ອິດ, ການລະເມີດໄດ້ຖືກເປີດເຜີຍໃນບັນດາຜູ້ອາໄສຢູ່ໃນບັນດາຊົນເຜົ່າ ທຳ ມະຊາດໃນອາຟຣິກາ, ເຊິ່ງມີລັກສະນະທີ່ມີຄວາມສົມດຸນຂອງໄນໂຕຣເຈນໃນທາງລົບ, ການ ທຳ ງານຂອງ ລຳ ໄສ້ທີ່ກະທົບກະເທືອນ, ກ້າມເນື້ອຫົດສົງແລະການເຕີບໂຕທີ່ບໍ່ສະດຸດ. ການຂາດທາດໂປຼຕີນບາງສ່ວນສາມາດເກີດຂື້ນກັບອາການທີ່ຄ້າຍຄືກັນ, ເຊິ່ງມັນອາດຈະບໍ່ຮຸນແຮງໃນບາງຄັ້ງ. ອັນຕະລາຍໂດຍສະເພາະແມ່ນການຂາດທາດໂປຼຕີນໃນຮ່າງກາຍຂອງເດັກ. ຄວາມຜິດປົກກະຕິກ່ຽວກັບອາຫານດັ່ງກ່າວສາມາດເຮັດໃຫ້ຄົນທີ່ ກຳ ລັງເຕີບໃຫຍ່ທາງດ້ານຮ່າງກາຍແລະສະຕິປັນຍາອ່ອນແອລົງ.
- ທາດໂປຼຕີນຫຼາຍເກີນໄປໃນຮ່າງກາຍເຮັດໃຫ້ລະບົບຂັບຖ່າຍ. ພາລະຂອງ ໝາກ ໄຂ່ຫຼັງເພີ່ມຂື້ນ. ດ້ວຍພະຍາດວິທະຍາທີ່ມີຢູ່ໃນເນື້ອເຍື່ອ ໝາກ ໄຂ່ຫຼັງ, ຂະບວນການດັ່ງກ່າວສາມາດຂະຫຍາຍໄດ້ຫຼາຍຂື້ນ. ມັນເປັນສິ່ງທີ່ບໍ່ດີຫຼາຍຖ້າມີທາດໂປຼຕີນຫຼາຍເກີນໄປໃນຮ່າງກາຍພ້ອມດ້ວຍການຂາດສ່ວນປະກອບອາຫານທີ່ມີຄ່າອື່ນໆ. ໃນສະ ໄໝ ກ່ອນ, ໃນບັນດາປະເທດໃນອາຊີມີວິທີການປະຫານຊີວິດ, ໃນນັ້ນການຕັດສິນໂທດໄດ້ຖືກລ້ຽງພຽງແຕ່ຊີ້ນ. ດັ່ງນັ້ນ, ຜູ້ກະ ທຳ ຜິດໄດ້ເສຍຊີວິດຍ້ອນການສ້າງຜະລິດຕະພັນເນົ່າເປື່ອຍໃນ ລຳ ໄສ້, ປະຕິບັດຕາມການເປັນພິດນີ້.
ວິທີການທີ່ສົມເຫດສົມຜົນໃນການສະ ໜອງ ທາດໂປຼຕີນໃຫ້ຮ່າງກາຍຮັບປະກັນການ ດຳ ເນີນງານທີ່ມີປະສິດຕິຜົນຂອງລະບົບຊີວິດທັງ ໝົດ.
ສຶກສາປະຫວັດສາດ

ທາດໂປຼຕີນດັ່ງກ່າວໄດ້ຮັບຄັ້ງທໍາອິດ (ໃນຮູບແບບຂອງ gluten) ໃນປີ 1728 ໂດຍ Jacopo Bartolomeo Beccari ຂອງອິຕາລີຈາກແປ້ງສາລີ. ທາດໂປຼຕີນຖືກແຍກອອກເປັນໂມເລກຸນທາງຊີວະວິທະຍາທີ່ແຍກຕ່າງຫາກໃນສະຕະວັດທີ 18 ເຊິ່ງເປັນຜົນມາຈາກການເຮັດວຽກຂອງນັກເຄມີສາດ Antoine de Fourcroix ຂອງຝຣັ່ງແລະນັກວິທະຍາສາດອື່ນໆທີ່ສັງເກດຄຸນສົມບັດຂອງທາດໂປຣຕີນເພື່ອ coagulate (ການຖົດຖອຍ) ພາຍໃຕ້ອິດທິພົນຂອງຄວາມຮ້ອນຫລືກົດ. ໃນເວລານັ້ນ, ທາດໂປຼຕີນເຊັ່ນ: albumin ("ໄຂ່ຂາວ"), fibrin (ທາດໂປຼຕີນຈາກເລືອດ), ແລະ gluten ຈາກເມັດເຂົ້າສາລີໄດ້ຖືກສືບສວນ.
ໃນຕົ້ນສະຕະວັດທີ 19, ຂໍ້ມູນບາງຢ່າງໄດ້ຮັບແລ້ວກ່ຽວກັບອົງປະກອບຂອງທາດໂປຼຕີນ; ມັນໄດ້ຖືກຮູ້ວ່າອາຊິດ amino ແມ່ນຖືກສ້າງຕັ້ງຂື້ນໃນໄລຍະທາດໂປຼຕີນຈາກທາດໂປຼຕິນ. ບາງສ່ວນຂອງອາຊິດ amino ເຫຼົ່ານີ້ (ເຊັ່ນ: glycine ແລະ leucine) ມີລັກສະນະແລ້ວ. ອີງຕາມການວິເຄາະຂອງອົງປະກອບທາງເຄມີຂອງທາດໂປຼຕີນ, ນັກເຄມີສາດໃນປະເທດໂຮນລັງທ່ານ Gerrit Mulder ໄດ້ສົມມຸດວ່າທາດໂປຼຕີນເກືອບທັງ ໝົດ ມີສູດທີ່ຄ້າຍຄືກັນ. ໃນປີ 1836, Mulder ໄດ້ສະ ເໜີ ຮູບແບບ ທຳ ອິດຂອງໂຄງສ້າງທາງເຄມີຂອງໂປຣຕີນ. ອີງຕາມທິດສະດີຂອງຮາກ, ລາວຫຼັງຈາກການປັບປຸງຫຼາຍຄັ້ງມາຮອດສະຫລຸບວ່າ ໜ່ວຍ ງານໂຄງສ້າງທີ່ ໜ້ອຍ ທີ່ສຸດຂອງທາດໂປຼຕີນມີສ່ວນປະກອບດັ່ງຕໍ່ໄປນີ້: C40ຮ62ນ10ອ12. ລາວເອີ້ນ ໜ່ວຍ ນີ້ວ່າ "ທາດໂປຼຕີນ" (Pr) (ຈາກພາສາກະເຣັກ. ໂປໂຕຄອນ - ທຳ ອິດ, ປະຖົມ), ແລະທິດສະດີ - "ທິດສະດີທາດໂປຼຕີນ". ຄຳ ວ່າ“ ທາດໂປຼຕີນ” ຕົວຂອງມັນເອງໄດ້ຖືກສະ ເໜີ ໂດຍນັກວິທະຍາສາດເຄມີຂອງປະເທດສະວີເດນທ່ານ Jacob Berzelius. ອີງຕາມ Mulder, ທາດໂປຼຕີນແຕ່ລະປະກອບດ້ວຍຫຼາຍຫົວ ໜ່ວຍ ໂປຣຕີນ, ຊູນຟູຣິກແລະຟົດສະຟໍຣັດ. ຍົກຕົວຢ່າງ, ລາວໄດ້ແນະ ນຳ ໃຫ້ຂຽນສູດ fibrin ເປັນ 10PrSP. Mulder ຍັງໄດ້ສຶກສາຜະລິດຕະພັນຂອງການ ທຳ ລາຍໂປຣຕີນ - ກົດອະມິໂນແລະ ສຳ ລັບ ໜຶ່ງ ໃນນັ້ນ (leucine) ໂດຍມີສ່ວນນ້ອຍໆຂອງຂໍ້ຜິດພາດ, ລາວໄດ້ ກຳ ນົດນ້ ຳ ໜັກ ໂມເລກຸນ - 131 ເມັດ. ດ້ວຍການສະສົມຂໍ້ມູນ ໃໝ່ ກ່ຽວກັບທາດໂປຼຕີນ, ທິດສະດີຂອງທາດໂປຼຕີນເລີ່ມຖືກວິພາກວິຈານ, ແຕ່, ເຖິງວ່າຈະມີເລື່ອງນີ້, ຈົນຮອດທ້າຍປີ 1850 ກໍ່ຍັງຖືວ່າເປັນທີ່ຍອມຮັບໃນທົ່ວໂລກ.
ໃນທ້າຍສະຕະວັດທີ 19, ສ່ວນໃຫຍ່ຂອງອາຊິດ amino ທີ່ຜະລິດໂປຣຕີນແມ່ນໄດ້ຖືກສືບສວນ. ໃນທ້າຍຊຸມປີ 1880. ນັກວິທະຍາສາດລັດເຊຍ A. Ya.Danilevsky ສັງເກດເຫັນວ່າມີກຸ່ມ peptide (CO - NH) ຢູ່ໃນໂມເລກຸນທາດໂປຼຕີນ. ໃນປີ 1894, ນັກວິທະຍາສາດດ້ານພູມສາດຂອງເຢຍລະມັນ Albrecht Kossel ໄດ້ວາງທິດສະດີຕາມທີ່ອາຊິດ amino ແມ່ນອົງປະກອບໂຄງສ້າງຫຼັກຂອງທາດໂປຣຕີນ. ໃນຕອນຕົ້ນຂອງສະຕະວັດທີ 20, ນັກເຄມີສາດເຢຍລະມັນ Emil Fischer ໄດ້ທົດລອງພິສູດວ່າທາດໂປຼຕີນປະກອບດ້ວຍທາດອາຊິດ amino ທີ່ເຊື່ອມຕໍ່ໂດຍພັນທະບັດ peptide. ລາວຍັງໄດ້ປະຕິບັດການວິເຄາະຄັ້ງ ທຳ ອິດກ່ຽວກັບ ລຳ ດັບອາຊິດ amino ຂອງທາດໂປຼຕີນແລະໄດ້ອະທິບາຍປະກົດການຂອງໂປຣຕີນ.
ເຖິງຢ່າງໃດກໍ່ຕາມ, ບົດບາດໃຈກາງຂອງທາດໂປຼຕີນໃນສິ່ງມີຊີວິດບໍ່ໄດ້ຖືກຮັບຮູ້ຈົນເຖິງປີ 1926, ໃນເວລາທີ່ນັກເຄມີສາດອາເມລິກາ James Sumner (ຕໍ່ມາໄດ້ຮັບລາງວັນໂນເບວໃນເຄມີສາດ) ໄດ້ສະແດງໃຫ້ເຫັນວ່າທາດ urease ແມ່ນທາດໂປຼຕີນ.
ຄວາມຫຍຸ້ງຍາກໃນການແຍກທາດໂປຼຕີນທີ່ບໍລິສຸດເຮັດໃຫ້ມັນຍາກທີ່ຈະສຶກສາ. ສະນັ້ນ, ການສຶກສາຄັ້ງ ທຳ ອິດໄດ້ ດຳ ເນີນການໂດຍ ນຳ ໃຊ້ສານໂປຼຕິນທີ່ສາມາດເຮັດຄວາມສະອາດໄດ້ຢ່າງງ່າຍດາຍໃນປະລິມານຫຼາຍ, ນັ້ນແມ່ນທາດໂປຼຕີນໃນເລືອດ, ໄຂ່ໄກ່, ສານພິດຕ່າງໆເຊັ່ນດຽວກັນກັບທາດຍ່ອຍອາຫານ / ທາດໂປຣຕີນທີ່ລັບພາຍຫຼັງຂ້າສັດ. ໃນທ້າຍຊຸມປີ 1950, ບໍລິສັດ ບໍລິສັດຫມາຮ້ອນ Armor. ສາມາດເກັບກູ້ໄດ້ກະເພາະອາຫານປະເພດ A, ເຊິ່ງໄດ້ກາຍເປັນເປົ້າ ໝາຍ ທົດລອງຂອງການສຶກສາຫຼາຍຢ່າງ.
ແນວຄວາມຄິດທີ່ວ່າໂຄງສ້າງຂັ້ນສອງຂອງທາດໂປຣຕີນແມ່ນຜົນມາຈາກການສ້າງພັນທະບັດໄຮໂດເຈນໃນລະຫວ່າງການຕົກຄ້າງຂອງກົດອະມິໂນທີ່ຖືກວາງອອກໂດຍ William Astbury ໃນປີ 1933, ແຕ່ວ່າ Linus Pauling ຖືວ່າເປັນນັກວິທະຍາສາດຜູ້ ທຳ ອິດທີ່ສາມາດຄາດຄະເນໂຄງສ້າງ ສຳ ຮອງຂອງທາດໂປຣຕີນ. ຕໍ່ມາ Walter Kausman, ໂດຍອີງໃສ່ວຽກງານຂອງ Kai Linnerstrom-Lang ໄດ້ປະກອບສ່ວນ ສຳ ຄັນເຂົ້າໃຈກົດ ໝາຍ ຂອງການສ້າງໂຄງປະກອບຊັ້ນສູງຂອງທາດໂປຣຕີນແລະບົດບາດຂອງການປະຕິ ສຳ ພັນ hydrophobic ໃນຂະບວນການນີ້. ໃນທ້າຍຊຸມປີ 1940 ແລະຕົ້ນຊຸມປີ 1950, Frederick Senger ໄດ້ພັດທະນາວິທີການ ສຳ ລັບການຈັດ ລຳ ດັບທາດໂປຼຕີນ, ໂດຍລາວໄດ້ ກຳ ນົດ ລຳ ດັບອາຊິດ amino ຂອງສອງຕ່ອງໂສ້ອິນຊູລິນໃນປີ 1955, ສະແດງໃຫ້ເຫັນວ່າທາດໂປຼຕີນແມ່ນໂພລິເມີໃນເສັ້ນຂອງອາຊິດ amino, ແລະບໍ່ແຕກງອກ (ຄືກັບນ້ ຳ ຕານບາງຢ່າງ ) ລະບົບຕ່ອງໂສ້, ໂຄມໄຟຫຼືວົງຈອນປິດ. ທາດໂປຼຕີນທໍາອິດ, ລໍາດັບອາຊິດ amino ທີ່ຖືກສ້າງຕັ້ງຂື້ນໂດຍນັກວິທະຍາສາດໂຊວຽດ / ຣັດເຊຍ, ແມ່ນໃນປີ 1972 aspartate aminotransferase.
ໂຄງສ້າງທາງກວ້າງຂອງພື້ນທີ່ ທຳ ອິດຂອງໂປຣຕີນທີ່ໄດ້ຮັບໂດຍການແຜ່ກະຈາຍ X-ray (ການວິເຄາະການແຜ່ກະຈາຍ X-ray) ໄດ້ຮູ້ຈັກກັນໃນທ້າຍຊຸມປີ 1950 ແລະຕົ້ນຊຸມປີ 1960, ແລະໂຄງສ້າງທີ່ຄົ້ນພົບໂດຍໃຊ້ການສະກົດຈິດນິວເຄຼຍໃນຊຸມປີ 1980. ໃນປີ 2012, ທະນາຄານຂໍ້ມູນໂປຼຕີນບັນຈຸໂຄງສ້າງທາດໂປຼຕີນປະມານ 87,000.
ໃນສະຕະວັດທີ 21, ການຄົ້ນຄວ້າທາດໂປຼຕີນໄດ້ກ້າວສູ່ລະດັບ ໃໝ່ ທີ່ມີຄຸນນະພາບ, ໃນເວລາທີ່ບໍ່ພຽງແຕ່ໄດ້ສຶກສາໂປຣຕີນທີ່ບໍລິສຸດແຕ່ລະຄົນ, ແຕ່ຍັງມີການປ່ຽນແປງ ຈຳ ນວນ ໜຶ່ງ ແລະການປ່ຽນແປງຫຼັງການແປພາສາຂອງໂປຣຕີນ ຈຳ ນວນຫຼວງຫຼາຍຂອງຈຸລັງ, ຈຸລັງຫຼືຈຸລິນຊີທັງ ໝົດ. ຂົງເຂດຊີວະເຄມີນີ້ເອີ້ນວ່າໂປຣໂມຊຽມ. ການ ນຳ ໃຊ້ວິທີການທາງຊີວະພາບ, ມັນໄດ້ກາຍເປັນໄປໄດ້ບໍ່ພຽງແຕ່ໃນການປະມວນຜົນຂໍ້ມູນຂອງການວິເຄາະການແຜ່ກະຈາຍ X-ray, ແຕ່ຍັງສາມາດຄາດຄະເນໂຄງສ້າງຂອງທາດໂປຼຕີນໂດຍອີງໃສ່ ລຳ ດັບອາຊິດ amino ຂອງມັນ. ໃນປະຈຸບັນ, ກ້ອງຈຸລະທັດ cryoelectron ຂອງສະລັບສັບຊ້ອນທາດໂປຼຕີນຂະ ໜາດ ໃຫຍ່ແລະການຄາດຄະເນໂຄງສ້າງທາງກວ້າງຂອງພື້ນທີ່ທາດໂປຼຕີນໂດຍໃຊ້ໂປແກຼມຄອມພິວເຕີ ກຳ ລັງເຂົ້າໃກ້ຄວາມຖືກຕ້ອງຂອງອາຕອມ.

ຂະ ໜາດ ຂອງທາດໂປຼຕີນສາມາດວັດແທກໄດ້ກ່ຽວກັບທາດເສດເຫຼືອອາຊິດ amino ຫຼືໃນທາດ daltons (ນ້ ຳ ໜັກ ໂມເລກຸນ), ແຕ່ເນື່ອງຈາກໂມເລກຸນຂະ ໜາດ ໃຫຍ່ພໍສົມຄວນ, ທາດໂປຼຕີນຈາກທາດໂປຼຕີນແມ່ນສະແດງອອກເປັນຫົວ ໜ່ວຍ ທີ່ໄດ້ມາ - kilodaltons (kDa). ທາດໂປຼຕີນຈາກເຊື້ອລາ, ໂດຍສະເລ່ຍ, ປະກອບດ້ວຍສານອາຊິດ amino amino 466 ແລະມີນ້ໍາຫນັກໂມເລກຸນຂອງ 53 kDa. ທາດໂປຼຕີນທີ່ໃຫຍ່ທີ່ສຸດທີ່ຮູ້ກັນໃນປະຈຸບັນ - titin - ແມ່ນສ່ວນປະກອບຂອງກ້າມ sarcomeres, ນ້ ຳ ໜັກ ໂມເລກຸນຂອງມັນ (isoforms) ຕ່າງໆກໍ່ມີຄວາມແຕກຕ່າງກັນໃນລະດັບຕັ້ງແຕ່ 3000 ເຖິງ 3700 kDa. Titin ຂອງກ້າມເນື້ອ soleus (lat. Soleus) ຂອງຄົນຜູ້ ໜຶ່ງ ປະກອບດ້ວຍອາຊິດ amino 38,388.
Amphotericity
ທາດໂປຼຕີນມີຄຸນສົມບັດຂອງ amphotericity, ນັ້ນແມ່ນ, ອີງຕາມເງື່ອນໄຂ, ພວກມັນສະແດງທັງຄຸນສົມບັດທີ່ເປັນກົດແລະພື້ນຖານ. ໃນທາດໂປຼຕີນ, ມີຫຼາຍປະເພດຂອງກຸ່ມເຄມີທີ່ມີຄວາມສາມາດ ionization ໃນການແກ້ໄຂທີ່ມີນ້ ຳ: ທາດເສດອາຊິດ carboxylic ຂອງຕ່ອງໂສ້ດ້ານຂ້າງຂອງອາຊິດ amino acid (ອາຊິດ aspartic ແລະ glutamic) ແລະກຸ່ມທີ່ມີທາດໄນໂຕຣເຈນຂອງຕ່ອງໂສ້ຂ້າງຂອງກົດ amino amino ພື້ນຖານ (ຕົ້ນຕໍແມ່ນກຸ່ມ amino-amino ຂອງ lysine ແລະທາດເສດເຫຼືອ CNH (NH)2) arginine, ໃນຂອບເຂດທີ່ນ້ອຍກວ່າ - ສານຕົກຄ້າງຂອງ imidazole histidine). ທາດໂປຼຕີນແຕ່ລະຕົວມີຈຸດທີ່ເປັນຈຸດ isoelectric (pI) - ຄວາມເປັນກົດໃນລະດັບປານກາງ (pH), ເຊິ່ງຄ່າໄຟຟ້າທັງ ໝົດ ຂອງໂມເລກຸນຂອງທາດໂປຼຕີນນີ້ແມ່ນສູນແລະ, ຕາມນັ້ນ, ພວກມັນບໍ່ເຄື່ອນຍ້າຍໃນສະ ໜາມ ໄຟຟ້າ (ຕົວຢ່າງ, ໂດຍໃຊ້ electrophoresis). ໃນຈຸດ isoelectric, hydration ແລະການລະລາຍຂອງທາດໂປຼຕີນແມ່ນຫນ້ອຍທີ່ສຸດ. ມູນຄ່າ pI ແມ່ນຂື້ນກັບອັດຕາສ່ວນຂອງການຕົກຄ້າງຂອງອາຊິດ amino ແລະຂັ້ນພື້ນຖານໃນທາດໂປຼຕີນ: ສຳ ລັບໂປຣຕີນທີ່ບັນຈຸທາດອາຊິດ amino ທີ່ເປັນກົດຫຼາຍ, ທາດ isoelectric ແມ່ນນອນຢູ່ໃນພາກພື້ນອາຊິດ (ທາດໂປຼຕີນດັ່ງກ່າວເອີ້ນວ່າອາຊິດ), ແລະໃນໂປຣຕີນທີ່ມີສ່ວນປະກອບພື້ນຖານຫຼາຍຂື້ນ, ພວກມັນແມ່ນຢູ່ໃນພາກພື້ນທີ່ເປັນດ່າງ (ທາດໂປຣຕີນພື້ນຖານ ) ມູນຄ່າ pI ຂອງທາດໂປຼຕີນນີ້ຍັງສາມາດແຕກຕ່າງກັນໄປຕາມຄວາມແຮງຂອງທາດ ionic ແລະຊະນິດຂອງໂຊລູຊັ່ນປ້ອງກັນທີ່ມັນຕັ້ງຢູ່, ເນື່ອງຈາກວ່າເກືອທີ່ເປັນກາງມີຜົນຕໍ່ລະດັບຂອງທາດ ionization ຂອງກຸ່ມທາດເຄມີ. ຕົວຢ່າງ pI ຂອງທາດໂປຼຕີນສາມາດຖືກ ກຳ ນົດຕົວຢ່າງຈາກເສັ້ນໂຄ້ງອັດຕາສ່ວນຫລືໂດຍຈຸດສຸມ isoelectric.
ໂດຍທົ່ວໄປ, pI ຂອງທາດໂປຼຕີນແມ່ນຂື້ນກັບ ໜ້າ ທີ່ທີ່ມັນປະຕິບັດ: ຈຸດ isoelectric ຂອງທາດໂປຼຕີນສ່ວນໃຫຍ່ໃນເນື້ອເຍື່ອກະດູກສັນຫຼັງຕັ້ງແຕ່ 5.5 ເຖິງ 7.0, ແຕ່ໃນບາງກໍລະນີຄຸນຄ່າຂອງມັນແມ່ນຢູ່ໃນພື້ນທີ່ທີ່ສຸດ: ຕົວຢ່າງເຊັ່ນ pepsin, ທາດ enzyme proteolytic ຂອງກະເພາະອາຫານທີ່ເປັນກົດ pI ນ້ໍາ
1, ແລະ ສຳ ລັບ salmin - ທາດໂປຼຕີນຈາກທາດໂປຼຕີນຈາກນົມປາແຊນມອນ, ຄຸນລັກສະນະຂອງມັນແມ່ນເນື້ອໃນທີ່ສູງຂອງ arginine - pI
12. ທາດໂປຼຕີນທີ່ຜູກພັນກັບອາຊິດນິວເຄຼຍເນື່ອງຈາກການພົວພັນລະບົບອິເລັກທໍນິກກັບກຸ່ມຟອສເຟດມັກຈະເປັນໂປຣຕີນຫຼັກ. ຕົວຢ່າງຂອງທາດໂປຼຕີນດັ່ງກ່າວແມ່ນ histones ແລະ protamines.
ທາດໂປຼຕີນແມ່ນຫຍັງ?
ທາດໂປຼຕີນແມ່ນທາດປະສົມສານອິນຊີທີ່ມີນ້ ຳ ໜັກ ໂມເລກຸນສູງປະກອບດ້ວຍສານອາຊິດ amino ທີ່ປະສົມເຂົ້າກັນ, ປະສົມກັນເປັນພິເສດ. ທາດໂປຼຕີນແຕ່ລະຕົວມີ ລຳ ດັບອາຊິດ amino ຂອງແຕ່ລະຄົນ, ສະຖານທີ່ຂອງມັນຢູ່ໃນອະວະກາດ. ມັນເປັນສິ່ງສໍາຄັນທີ່ຈະເຂົ້າໃຈວ່າທາດໂປຼຕີນທີ່ເຂົ້າໄປໃນຮ່າງກາຍບໍ່ໄດ້ຖືກດູດຊຶມຈາກພວກມັນໃນຮູບແບບທີ່ບໍ່ປ່ຽນແປງ, ພວກມັນຖືກແຍກອອກເປັນອາຊິດ amino ແລະດ້ວຍການຊ່ວຍເຫຼືອຂອງຮ່າງກາຍໃນການສັງເຄາະໂປຣຕີນຂອງມັນ.
ອາຊິດ amino 22 ມີສ່ວນຮ່ວມໃນການສ້າງທາດໂປຼຕີນ, 13 ໃນນັ້ນສາມາດປ່ຽນເປັນກັນເອງ, 9 - phenylalanine, tryptophan, lysine, histidine, threonine, leucine, valine, isoleucine, methionine - ແມ່ນບໍ່ສາມາດປ່ຽນແທນໄດ້. ການຂາດອາຊິດທີ່ບໍ່ປ່ຽນແປງໃນຮ່າງກາຍແມ່ນບໍ່ສາມາດຍອມຮັບໄດ້, ນີ້ຈະ ນຳ ໄປສູ່ການ ທຳ ລາຍຮ່າງກາຍ.
ມັນເປັນສິ່ງສໍາຄັນບໍ່ພຽງແຕ່ຄວາມຈິງທີ່ວ່າທາດໂປຼຕີນທີ່ເຂົ້າໄປໃນຮ່າງກາຍ, ແຕ່ມັນກໍ່ຍັງມີອາຊິດ amino ທີ່ມັນປະກອບດ້ວຍ!

ທາດໂປຼຕີນແມ່ນຫຍັງ?
ທາດໂປຼຕີນ (ທາດໂປຼຕີນ / polypeptides) - ສານອິນຊີ, ໂພລິເມີ ທຳ ມະຊາດທີ່ບັນຈຸມີກົດອາມີ amino 20 ຊະນິດທີ່ກ່ຽວຂ້ອງ. ການປະສົມປະສານໃຫ້ຫລາຍປະເພດ. ຮ່າງກາຍຮັບມືກັບການສັງເຄາະຂອງອາຊິດ amino amino ສອງທີ່ປ່ຽນແປງໄດ້ເອງ.
ແປດຂອງຊາວອາຊິດ amino ທີ່ ສຳ ຄັນທີ່ພົບໃນໂປຣຕີນບໍ່ສາມາດຖືກສັງເຄາະໂດຍຮ່າງກາຍດ້ວຍຕົວມັນເອງ, ພວກມັນໄດ້ຮັບຈາກອາຫານ. ເຫຼົ່ານີ້ແມ່ນ valine, leucine, isoleucine, methionine, tryptophan, lysine, threonine, phenylalanine, ເຊິ່ງມີຄວາມ ສຳ ຄັນຕໍ່ຊີວິດ.
ທາດໂປຼຕີນຈະເກີດຫຍັງຂຶ້ນ
ຈຳ ແນກລະຫວ່າງສັດແລະພືດຜັກ (ໂດຍ ກຳ ເນີດ). ສອງປະເພດການບໍລິໂພກແມ່ນຕ້ອງການ.
ສັດ:
ໄຂ່ຂາວແມ່ນງ່າຍແລະເກືອບຈະດູດຊືມຈາກຮ່າງກາຍ (90-92%). ທາດໂປຼຕີນຈາກຜະລິດຕະພັນນົມດອງແມ່ນຮ້າຍແຮງກວ່າເກົ່າ (ເຖິງ 90%). ທາດໂປຼຕີນຈາກນົມສົດສົດຈະຖືກດູດຊືມເຖິງວ່າຈະ ໜ້ອຍ (ເຖິງ 80%).
ຄຸນຄ່າຂອງຊີ້ນງົວແລະປາໃນການປະສົມປະສານທີ່ດີທີ່ສຸດຂອງອາຊິດ amino ທີ່ ຈຳ ເປັນ.
ຜັກ:
ຖົ່ວເຫລືອງ, canola ແລະ cottonseed ມີອັດຕາສ່ວນຂອງກົດອະມິໂນທີ່ດີຕໍ່ຮ່າງກາຍ. ໃນການປູກພືດ, ອັດຕາສ່ວນນີ້ແມ່ນອ່ອນກວ່າ.
ບໍ່ມີຜະລິດຕະພັນໃດທີ່ມີອັດຕາສ່ວນຂອງກົດອະມິໂນທີ່ ເໝາະ ສົມ. ໂພຊະນາການທີ່ ເໝາະ ສົມກ່ຽວຂ້ອງກັບການປະສົມທາດໂປຼຕີນຈາກສັດແລະຜັກ.
ພື້ນຖານຂອງໂພຊະນາການ "ໂດຍກົດລະບຽບ" ແມ່ນທາດໂປຼຕີນຈາກສັດ. ມັນອຸດົມໄປດ້ວຍກົດອະມິໂນທີ່ ຈຳ ເປັນ, ແລະສະ ໜອງ ທາດໂປຼຕີນຈາກຜັກໃນການດູດຊຶມໄດ້ດີ.
ໂປຣຕີນເຮັດ ໜ້າ ທີ່ໃນຮ່າງກາຍ
ຢູ່ໃນຈຸລັງຂອງເນື້ອເຍື່ອ, ມັນປະຕິບັດຫນ້າທີ່ຫຼາຍຢ່າງ:
- ປ້ອງກັນ. ການເຮັດວຽກຂອງລະບົບພູມຕ້ານທານແມ່ນການເປັນກາງຂອງສານຕ່າງປະເທດ. ການຜະລິດຢາຕ້ານເຊື້ອເກີດຂື້ນ.
- ການຂົນສົ່ງ. ການສະ ໜອງ ສານຕ່າງໆ, ຍົກຕົວຢ່າງ, hemoglobin (ການສະ ໜອງ ອົກຊີເຈນ).
- ກົດລະບຽບ. ການຮັກສາພື້ນຫລັງຮໍໂມນ.
- ການກະຕຸ້ນ. ທຸກໆປະເພດຂອງການເຄື່ອນໄຫວໃຫ້ actin ແລະ myosin.
- ພາດສະຕິກ. ສະພາບຂອງຈຸລັງເຊື່ອມຕໍ່ຖືກຄວບຄຸມໂດຍເນື້ອໃນຂອງ collagen.
- ກະຕຸ້ນ. ມັນແມ່ນຕົວກະຕຸ້ນແລະເລັ່ງການຜ່ານຂອງປະຕິກິລິຍາທາງຊີວະເຄມີທັງ ໝົດ.
- ການອະນຸລັກແລະສົ່ງຕໍ່ຂໍ້ມູນພັນທຸ ກຳ (ໂມເລກຸນ DNA ແລະ RNA).
- ພະລັງງານ. ການສະ ໜອງ ຂອງຮ່າງກາຍທັງ ໝົດ ດ້ວຍພະລັງງານ.
ຄົນອື່ນໃຫ້ການຫາຍໃຈ, ມີຄວາມຮັບຜິດຊອບຕໍ່ການຍ່ອຍອາຫານ, ຄວບຄຸມການເຜົາຜານອາຫານ. ທາດໂປຼຕີນຈາກ rahodopsin ແມ່ນຮັບຜິດຊອບຕໍ່ການເຮັດວຽກຂອງສາຍຕາ.
ເສັ້ນເລືອດມີ elastin, ຍ້ອນມັນພວກມັນເຮັດວຽກຢ່າງເຕັມທີ່. ທາດໂປຼຕີນຈາກ fibrinogen ໃຫ້ຄວາມແຂງກະດ້າງຂອງເລືອດ.
ອາການຂອງການຂາດທາດໂປຼຕີນໃນຮ່າງກາຍ
ການຂາດທາດໂປຼຕີນແມ່ນພົບເລື້ອຍທີ່ພົບພໍ້ກັບການຂາດສານອາຫານແລະວິຖີຊີວິດທີ່ ໜ້າ ກຽດຊັງຂອງຄົນຍຸກ ໃໝ່. ໃນຮູບແບບອ່ອນໆມັນຖືກສະແດງອອກໃນຄວາມອ່ອນເພຍແລະການປະຕິບັດທີ່ບໍ່ດີ. ດ້ວຍການເພີ່ມປະລິມານທີ່ບໍ່ພຽງພໍ, ຮ່າງກາຍຈະສົ່ງສັນຍານຜ່ານອາການ:
- ຄວາມອ່ອນແອທົ່ວໄປແລະວິນຫົວ. ການຫຼຸດຜ່ອນອາລົມແລະກິດຈະ ກຳ, ລັກສະນະຂອງຄວາມອິດເມື່ອຍຂອງກ້າມເນື້ອໂດຍບໍ່ມີການອອກ ກຳ ລັງກາຍພິເສດ, ການປະສານງານທີ່ບໍ່ສົມຄວນຂອງການເຄື່ອນໄຫວ, ການເຮັດໃຫ້ຄວາມສົນໃຈແລະຄວາມ ຈຳ ອ່ອນລົງ.
- ອາການເຈັບຫົວແລະການນອນຫຼັບທີ່ຮ້າຍແຮງ. ການນອນໄມ່ຫລັບແລະຄວາມກັງວົນທີ່ເປັນຜົນສະແດງໃຫ້ເຫັນການຂາດ serotonin.
- ອາລົມປັ່ນປ່ວນເລື້ອຍໆ, ກະວົນກະວາຍ. ການຂາດທາດ enzymes ແລະຮໍໂມນເຮັດໃຫ້ເກີດຄວາມອິດເມື່ອຍຂອງລະບົບປະສາດ: ອາການຄັນຄາຍຍ້ອນເຫດຜົນໃດກໍ່ຕາມ, ການຮຸກຮານທີ່ບໍ່ສົມເຫດສົມຜົນ, ຄວາມອົດກັ້ນທາງອາລົມ.
- ຜິວ ໜັງ ຈາງ, ຜື່ນຄັນ. ດ້ວຍການຂາດທາດໂປຼຕີນທີ່ມີທາດເຫຼັກ, ພະຍາດເລືອດຈາງຈະເກີດຂື້ນ, ອາການຂອງຄວາມແຫ້ງແລະ ໜ້າ ຜາກຂອງຜິວ ໜັງ, ເຍື່ອເມືອກ.
- ການໃຄ່ບວມທີ່ສຸດ. ປະລິມານທາດໂປຼຕີນຈາກ plasma ຕໍ່າເຮັດໃຫ້ຄວາມສົມດຸນຂອງນ້ ຳ ເກືອຫຼຸດລົງ. ໄຂມັນ subcutaneous ສະສົມນ້ ຳ ໃນຂໍ້ຕີນແລະຂໍ້ຕີນ.
- ການຮັກສາທີ່ບໍ່ດີຂອງບາດແຜແລະແຜ. ການສ້ອມແປງຈຸລັງຖືກຍັບຍັ້ງເນື່ອງຈາກການຂາດ "ວັດສະດຸກໍ່ສ້າງ".
- ຄວາມອ່ອນແອແລະການສູນເສຍຜົມ, ຄວາມອ່ອນແອຂອງເລັບ. ຮູບລັກສະນະຂອງຜີວ ໜັງ ເນື່ອງຈາກຜິວແຫ້ງ, ການ ກຳ ຈັດແລະການແຕກຂອງແຜ່ນເລັບແມ່ນສັນຍານທົ່ວໄປທີ່ສຸດຂອງຮ່າງກາຍກ່ຽວກັບການຂາດທາດໂປຼຕີນ. ຜົມແລະເລັບມີການຂະຫຍາຍຕົວຢ່າງຕໍ່ເນື່ອງແລະຕອບສະ ໜອງ ຕໍ່ການຂາດສານທີ່ສົ່ງເສີມການຈະເລີນເຕີບໂຕແລະສະພາບທີ່ດີ.
- ການສູນເສຍນ້ ຳ ໜັກ ທີ່ບໍ່ສົມເຫດສົມຜົນ. ການຫາຍໄປຂອງນໍ້າ ໜັກ ກິໂລກຣາມໂດຍບໍ່ມີເຫດຜົນຫຍັງແມ່ນຍ້ອນຄວາມ ຈຳ ເປັນຂອງຮ່າງກາຍໃນການຊົດເຊີຍການຂາດທາດໂປຼຕີນເນື່ອງຈາກມີກ້າມເນື້ອ.
- ຄວາມລົ້ມເຫຼວຂອງຫົວໃຈແລະເສັ້ນເລືອດ, ຮູບລັກສະນະຂອງລົມຫາຍໃຈສັ້ນ. ລະບົບຫາຍໃຈ, ຍ່ອຍອາຫານແລະລະບົບ genitourinary ກໍ່ຊຸດໂຊມລົງ. ພະຍາດຕາບອດປະກົດວ່າບໍ່ມີການອອກ ກຳ ລັງກາຍ, ໄອໂດຍບໍ່ເປັນຫວັດແລະໂລກໄວຣັດ.
ດ້ວຍຮູບລັກສະນະຂອງອາການຂອງຊະນິດນີ້, ທ່ານຄວນປ່ຽນອາຫານແລະຄຸນນະພາບຂອງອາຫານໂດຍທັນທີ, ພິຈາລະນາວິຖີຊີວິດຂອງທ່ານ, ແລະຖ້າມີອາການຮຸນແຮງຂື້ນ, ໃຫ້ປຶກສາທ່ານ ໝໍ.
ຕ້ອງການທາດໂປຼຕີນຫຼາຍປານໃດ ສຳ ລັບການດູດຊຶມ
ອັດຕາການຊົມໃຊ້ຕໍ່ມື້ແມ່ນຂື້ນກັບອາຍຸ, ເພດ, ປະເພດວຽກ. ຂໍ້ມູນກ່ຽວກັບມາດຕະຖານແມ່ນ ນຳ ສະ ເໜີ ຢູ່ໃນຕາຕະລາງ (ຂ້າງລຸ່ມ) ແລະຖືກອອກແບບ ສຳ ລັບ ນຳ ້ ໜັກ.
ການຮວບຮວມການໄດ້ຮັບທາດໂປຼຕີນຫຼາຍຄັ້ງເປັນທາງເລືອກ. ແຕ່ລະຄົນ ກຳ ນົດຮູບແບບທີ່ສະດວກ ສຳ ລັບຕົນເອງ, ສິ່ງ ສຳ ຄັນແມ່ນການຮັກສາອັດຕາຮັບປະ ຈຳ ວັນ.
| ກິດຈະ ກຳ ແຮງງານ + |
ກິດຈະກໍາທາງດ້ານຮ່າງກາຍ
ປະລິມານທາດໂປຼຕີນສູງໃນອາຫານ
ອາຫານທີ່ມີທາດໂປຼຕີນທີ່ຮັບຮູ້:
ໃນທຸກຊະນິດຂອງຊີ້ນ, ຊີ້ນງົວຈະຢູ່ໃນອັນດັບ ທຳ ອິດຫຼັງຈາກເນື້ອທີ່ສັດປີກ: 18,9 g ຫລັງຈາກນັ້ນ, ຊີ້ນ ໝູ: 16,4 g, ລູກແກະ: 16,2 g.
ອາຫານທະເລແລະປາມຶກແມ່ນຜູ້ ນຳ: 18.0 ກຣາມ.
ປາທີ່ມີທາດໂປຼຕີນສູງທີ່ສຸດແມ່ນປາແຊນມອນ: 21,8 ກຼາມ, ປາແຊນມອນສີບົວ: 21 g, zander: 19 ກຼາມ, ໝາກ ເສືອ: 18 ກຼາມ, ຝູງສັດ: 17,6 ກຣາມແລະ cod: 17,5 g.
ໃນບັນດາຜະລິດຕະພັນນົມ, kefir ແລະຄຣີມສົ້ມສາມາດຮັກສາ ຕຳ ແໜ່ງ ໄດ້: 3.0 g, ຈາກນັ້ນນົມ: 2.8 g.
ເມັດພືດສູງ - ເມັດພືດ: 13.1 g, ເມັດ: 11,5 g, semolina: 11.3 g
ໂດຍຮູ້ເຖິງມາດຕະຖານແລະ ຄຳ ນຶງເຖິງໂອກາດທາງການເງິນ, ທ່ານສາມາດປະກອບເມນູຢ່າງຖືກຕ້ອງແລະ ໝັ້ນ ໃຈວ່າຈະເສີມມັນດ້ວຍໄຂມັນແລະຄາໂບໄຮເດຣດ.
ອັດຕາສ່ວນຂອງທາດໂປຼຕີນໃນໂພຊະນາການ
ອັດຕາສ່ວນຂອງໂປຣຕີນ, ໄຂມັນ, ທາດແປ້ງໃນຄາບອາຫານທີ່ດີຕໍ່ສຸຂະພາບຄວນຈະເປັນ (ເປັນກຼາມ) 1: 1: 4. ກຸນແຈ ສຳ ຄັນຕໍ່ຄວາມສົມດຸນຂອງອາຫານທີ່ມີສຸຂະພາບດີສາມາດເປັນຕົວແທນໃນທາງອື່ນ: ໂປຣຕີນ 25-35%, ໄຂມັນ 25-35%, ທາດແປ້ງ 30-50%.
ໃນເວລາດຽວກັນ, ໄຂມັນຄວນຈະເປັນປະໂຫຍດ: ນ້ ຳ ມັນມະກອກຫລືເສັ້ນລ້ອນ, ແກ່ນ, ປາ, ຊີດ.
ຄາໂບໄຮເດຣດໃນຈານແມ່ນເຂົ້າ ໜົມ ແຂງ, ຜັກສົດໃດໆ, ພ້ອມທັງ ໝາກ ໄມ້ / ໝາກ ໄມ້ແຫ້ງ, ຜະລິດຕະພັນນົມສົ້ມ.
ທາດໂປຼຕີນໃນສ່ວນຕ່າງໆສາມາດຖືກລວມເຂົ້າກັນໄດ້: ຜັກ + ສັດ.
ອາຊິດ amino ທີ່ບັນຈຸຢູ່ໃນທາດໂປຼຕີນ
ການແລກປ່ຽນກັນໄດ້ສາມາດໄດ້ຮັບການສັງເຄາະໂດຍຕົວຂອງມັນເອງ, ແຕ່ວ່າການສະ ໜອງ ຂອງພວກມັນຈາກພາຍນອກແມ່ນບໍ່ມີປະໂຫຍດຫຍັງເລີຍ. ໂດຍສະເພາະກັບວິຖີຊີວິດທີ່ຫ້າວຫັນແລະການອອກ ກຳ ລັງກາຍທີ່ດີເລີດ.
ທັງ ໝົດ ໂດຍບໍ່ມີຂໍ້ຍົກເວັ້ນແມ່ນ ສຳ ຄັນ, ເປັນທີ່ນິຍົມທີ່ສຸດຂອງພວກເຂົາ:
ອານນານ.
ມັນກະຕຸ້ນການເຜົາຜະຫລານທາດແປ້ງ, ຊ່ວຍ ກຳ ຈັດສານພິດ. ຮັບຜິດຊອບຕໍ່“ ຄວາມສະອາດ”. ເນື້ອໃນສູງໃນຊີ້ນ, ປາ, ຜະລິດຕະພັນນົມ.
Arginine.
ມັນເປັນສິ່ງຈໍາເປັນທີ່ຈະເຮັດສັນຍາກ້າມເນື້ອ, ຜິວທີ່ແຂງແຮງ, ກະດູກແຂນແລະຂໍ້ຕໍ່. ສະ ໜອງ ການເຜົາຜານໄຂມັນແລະລະບົບພູມຕ້ານທານ. ມັນແມ່ນຢູ່ໃນຊີ້ນ, ນົມ, ແກ່ນໃດໆ, gelatin.
ອາຊິດ Aspartic.
ໃຫ້ຄວາມສົມດຸນຂອງພະລັງງານ. ປັບປຸງການເຮັດວຽກຂອງລະບົບປະສາດສ່ວນກາງ. ຕອບແທນຢ່າງດີຂອງຊັບພະຍາກອນພະລັງງານຂອງຊີ້ນງົວແລະຖ້ວຍໄກ່, ນົມ, ນ້ ຳ ຕານອ້ອຍ. ບັນຈຸໃນມັນຕົ້ນ, ແກ່ນ, ເມັດທັນຍາພືດ.
ນັກປະຫວັດສາດ.
"ຜູ້ກໍ່ສ້າງ" ຕົ້ນຕໍຂອງຮ່າງກາຍແມ່ນປ່ຽນເປັນ histamine ແລະ hemoglobin. ປິ່ນປົວບາດແຜໃຫ້ໄວ, ມີຄວາມຮັບຜິດຊອບຕໍ່ກົນໄກການຈະເລີນເຕີບໂຕ. ຂ້ອນຂ້າງຫຼາຍໃນນົມ, ທັນຍາພືດແລະຊີ້ນ.
Serene.
Neurotransmitter, ທີ່ຂາດບໍ່ໄດ້ ສຳ ລັບການເຮັດວຽກທີ່ຊັດເຈນຂອງລະບົບສະ ໝອງ ແລະລະບົບປະສາດສ່ວນກາງ. ມີຖົ່ວດິນ, ຊີ້ນ, ທັນຍາພືດ, ຖົ່ວເຫລືອງ.
ດ້ວຍສານອາຫານທີ່ ເໝາະ ສົມແລະວິຖີຊີວິດທີ່ຖືກຕ້ອງ, ກົດອະມິໂນທຸກຊະນິດຈະປາກົດຢູ່ໃນຮ່າງກາຍ ສຳ ລັບການສັງເຄາະ "ຄິວ" ແລະແບບຢ່າງຂອງສຸຂະພາບ, ຄວາມງາມແລະອາຍຸຍືນ.
ສາເຫດທີ່ເຮັດໃຫ້ຂາດໂປຕີນໃນຮ່າງກາຍ
- ພະຍາດຕິດຕໍ່ເລື້ອຍໆ, ເຮັດໃຫ້ລະບົບພູມຕ້ານທານອ່ອນແອລົງ.
- ຄວາມຕຶງຄຽດແລະຄວາມກັງວົນໃຈ.
- ຜູ້ສູງອາຍຸແລະຊ້າລົງຂອງທຸກໆຂະບວນການຂອງລະບົບການເຜົາຜະຫລານອາຫານ.
- ຜົນຂ້າງຄຽງຂອງການໃຊ້ຢາແຕ່ລະຊະນິດ.
- ຄວາມລົ້ມເຫຼວໃນລະບົບຍ່ອຍອາຫານ.
- ບາດເຈັບ
- ອາຫານໂດຍອີງໃສ່ອາຫານໄວ, ຜະລິດຕະພັນທັນທີ, ຜະລິດຕະພັນເຄິ່ງ ສຳ ເລັດຮູບທີ່ມີຄຸນນະພາບຕ່ ຳ.
ການຂາດທາດອາຊິດ amino ດຽວຈະຢຸດການຜະລິດໂປຕີນສະເພາະ. ຮ່າງກາຍໄດ້ຖືກຈັດຕັ້ງຂື້ນໂດຍອີງໃສ່ຫຼັກການ "ຕື່ມຂໍ້ມູນສຽງດັງ", ສະນັ້ນອາຊິດ amino ທີ່ຫາຍໄປຈະຖືກສະກັດອອກມາຈາກໂປຣຕີນອື່ນໆ. "ການສ້າງສາຄືນ ໃໝ່" ນີ້ກໍ່ລົບກວນການເຮັດວຽກຂອງອະໄວຍະວະ, ກ້າມເນື້ອ, ຫົວໃຈ, ສະ ໝອງ ແລະເປັນການກະຕຸ້ນຕໍ່ພະຍາດຕໍ່ມາ.
ການຂາດທາດໂປຼຕີນໃນເດັກນ້ອຍຍັບຍັ້ງການຈະເລີນເຕີບໂຕ, ເປັນສາເຫດຂອງຄວາມພິການທາງຮ່າງກາຍແລະຈິດໃຈ.
ການພັດທະນາຂອງໂລກເລືອດຈາງ, ລັກສະນະຂອງພະຍາດຜິວຫນັງ, ພະຍາດທາງກະດູກແລະເນື້ອເຍື່ອກ້າມຊີ້ນບໍ່ແມ່ນບັນຊີລາຍຊື່ທີ່ສົມບູນຂອງພະຍາດ. ໂຣກຕັບໂປຼຕີນທີ່ຮ້າຍແຮງສາມາດສົ່ງຜົນໃຫ້ເປັນບ້າແລະ kwashiorkor (ປະເພດຂອງໂຣກຕັບແຂງເນື່ອງຈາກຂາດໂປຣຕີນ).
ເມື່ອທາດໂປຼຕີນ ທຳ ລາຍຮ່າງກາຍ
- ການຕ້ອນຮັບເກີນ
- ພະຍາດ ຊຳ ເຮື້ອຂອງຕັບ, ໝາກ ໄຂ່ຫຼັງ, ຫົວໃຈແລະຫຼອດເລືອດ.
Oversupply ບໍ່ເກີດຂື້ນເລື້ອຍໆຍ້ອນການດູດຊຶມສານທີ່ບໍ່ສົມບູນໂດຍຮ່າງກາຍ.ມັນເກີດຂື້ນໃນຜູ້ທີ່ຕ້ອງການເພີ່ມກ້າມເນື້ອໄວເທົ່າທີ່ຈະໄວໄດ້ໂດຍບໍ່ຕ້ອງປະຕິບັດຕາມ ຄຳ ແນະ ນຳ ຂອງຄູຝຶກແລະນັກໂພຊະນາການ.
ບັນຫາຂອງການຕ້ອນຮັບ“ ເກີນ” ປະກອບມີ:
ຄວາມລົ້ມເຫຼວຂອງຫມາກໄຂ່ຫຼັງ. ປະລິມານຫຼາຍເກີນໄປຂອງທາດໂປຼຕີນ overload ອະໄວຍະວະ, ລົບກວນການເຮັດວຽກທໍາມະຊາດຂອງມັນ. "ການກັ່ນຕອງ" ບໍ່ສາມາດຮັບມືກັບການໂຫຼດ, ໂຣກຫມາກໄຂ່ຫຼັງຈະປາກົດ.
ພະຍາດຕັບ. ທາດໂປຼຕີນຫຼາຍເກີນໄປຈະສະສົມອາໂມນຽມໃນເລືອດເຊິ່ງເຮັດໃຫ້ສະພາບຂອງຕັບຊຸດໂຊມລົງ.
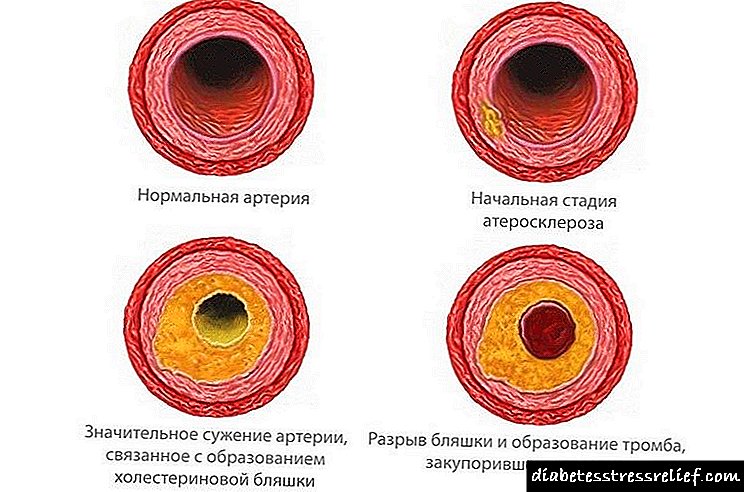
ການພັດທະນາຂອງໂຣກ atherosclerosis. ຜະລິດຕະພັນສັດສ່ວນໃຫຍ່, ນອກ ເໜືອ ຈາກສານທີ່ມີປະໂຫຍດ, ມັນມີໄຂມັນແລະຄໍເລສເຕີຣອນທີ່ເປັນອັນຕະລາຍ.
ຄົນທີ່ເປັນໂຣກໂຣກຕັບ, ໝາກ ໄຂ່ຫຼັງ, ລະບົບຫົວໃຈແລະລະບົບຍ່ອຍອາຫານຄວນ ຈຳ ກັດການໄດ້ຮັບທາດໂປຼຕີນ.
ການເບິ່ງແຍງສຸຂະພາບຂອງຕົນເອງແມ່ນໄດ້ຮັບຜົນຕອບແທນຈາກຜູ້ທີ່ກັງວົນກ່ຽວກັບມັນ. ເພື່ອຫລີກລ້ຽງຜົນສະທ້ອນທີ່ຮ້າຍແຮງ, ທ່ານ ຈຳ ເປັນຕ້ອງຈື່ ຈຳ ຄວາມ ຈຳ ເປັນຂອງຮ່າງກາຍໃນການຟື້ນຟູ. ການພັກຜ່ອນຢ່າງເຕັມທີ່, ໂພຊະນາການ, ຜູ້ຊ່ຽວຊານດ້ານການຢ້ຽມຢາມຈະຍືດເຍື້ອໄວ ໜຸ່ມ, ສຸຂະພາບແລະຊີວິດ.
ການລະລາຍ
ທາດໂປຼຕີນແຕກຕ່າງກັນໃນລະດັບຂອງການລະລາຍໃນນໍ້າ. ທາດໂປຼຕີນທີ່ລະລາຍໃນນ້ໍາໄດ້ຖືກເອີ້ນວ່າ albumin, ເຫຼົ່ານີ້ປະກອບມີທາດໂປຼຕີນຈາກເລືອດແລະນົມ. Insoluble, ຫຼື scleroproteins, ປະກອບມີ, keratin (ທາດໂປຼຕີນທີ່ເຮັດໃຫ້ຜົມ, ຜົມຂອງສັດລ້ຽງລູກດ້ວຍນົມ, ສັດປີກຂອງສັດປີກ, ແລະອື່ນໆ) ແລະ fibroin, ເຊິ່ງແມ່ນສ່ວນຫນຶ່ງຂອງຜ້າໄຫມແລະ cobwebs. ການລະລາຍຂອງທາດໂປຼຕີນແມ່ນຖືກ ກຳ ນົດບໍ່ພຽງແຕ່ໂດຍໂຄງສ້າງຂອງມັນເທົ່ານັ້ນແຕ່ມັນກໍ່ແມ່ນປັດໃຈພາຍນອກເຊັ່ນລັກສະນະຂອງທາດລະລາຍ, ຄວາມແຮງຂອງທາດ ionic ແລະ pH ຂອງວິທີແກ້ໄຂ.
ທາດໂປຼຕີນຍັງຖືກແບ່ງອອກເປັນ hydrophilic (water-soluble) ແລະ hydrophobic (repellent water). ທາດໂປຼຕີນສ່ວນໃຫຍ່ຂອງ cytoplasm, nucleus, ແລະສານ intercellular, ລວມທັງ keratin ແລະ fibroin ທີ່ບໍ່ສາມາດລະລາຍໄດ້, ແມ່ນ hydrophilic. ທາດໂປຼຕີນສ່ວນຫຼາຍທີ່ປະກອບເປັນເຍື່ອຊີວະພາບແມ່ນທາດໂປຼຕີນຈາກເຍື່ອປະສົມປະສານທີ່ພົວພັນກັບ lipid hydrophobic ຂອງເຍື່ອ (ທາດໂປຼຕີນເຫຼົ່ານີ້ມັກຈະມີສະຖານທີ່ໄຮໂດຼລິກ).
Biosynthesis ທາດໂປຼຕີນໃນຮ່າງກາຍ
biosynthesis ທາດໂປຼຕີນ - ການສ້າງຕັ້ງໃນຮ່າງກາຍຂອງທາດໂປຼຕີນທີ່ຕ້ອງການຈາກອາຊິດ amino ໂດຍການສົມທົບພວກມັນກັບປະເພດພິເສດຂອງພັນທະບັດເຄມີ - ລະບົບຕ່ອງໂສ້ polypeptide. DNA ເກັບຂໍ້ມູນກ່ຽວກັບໂຄງສ້າງຂອງໂປຣຕີນ. ການສັງເຄາະຕົວມັນເອງເກີດຂື້ນໃນພາກສ່ວນພິເສດຂອງຈຸລັງທີ່ເອີ້ນວ່າກະດູກສັນຫຼັງ. RNA ໂອນຂໍ້ມູນຈາກ gene ທີ່ຕ້ອງການ (ເວັບໄຊທ໌ DNA) ໄປຫາກະດູກສັນຫຼັງ.
ເນື່ອງຈາກວ່າການຜະລິດສານເຄມີທາງຊີວະພາບແມ່ນມີຄວາມຫຼາກຫຼາຍ, ສັບຊ້ອນ, ໃຊ້ຂໍ້ມູນທີ່ວາງໄວ້ໃນພື້ນຖານຂອງການມີຊີວິດຂອງມະນຸດ - DNA, ການສັງເຄາະສານເຄມີຂອງມັນແມ່ນວຽກທີ່ຍາກ. ນັກວິທະຍາສາດໄດ້ຮຽນຮູ້ວິທີທີ່ຈະໄດ້ຮັບສານຍັບຍັ້ງຂອງເອນໄຊແລະຮໍໂມນທີ່ແນ່ນອນ, ແຕ່ວຽກງານວິທະຍາສາດທີ່ ສຳ ຄັນທີ່ສຸດແມ່ນການໄດ້ຮັບທາດໂປຼຕີນໂດຍໃຊ້ວິສະວະ ກຳ ທາງພັນທຸ ກຳ.

ການຂົນສົ່ງ
ຫນ້າທີ່ການຂົນສົ່ງຂອງໂປຕີນໃນເລືອດພິເສດ - hemoglobin. ຂໍຂອບໃຈກັບທາດໂປຼຕີນນີ້, ອົກຊີເຈນໄດ້ຖືກສົ່ງຈາກປອດໄປສູ່ອະໄວຍະວະແລະແພຈຸລັງຂອງຮ່າງກາຍ.
ມັນປະກອບດ້ວຍໃນກິດຈະ ກຳ ຂອງໂປຣຕີນຂອງລະບົບພູມຕ້ານທານທີ່ເອີ້ນວ່າພູມຕ້ານທານ. ມັນແມ່ນພູມຕ້ານທານທີ່ຊ່ວຍຮັກສາສຸຂະພາບຂອງຮ່າງກາຍ, ປົກປ້ອງມັນຈາກເຊື້ອແບັກທີເຣຍ, ໄວຣັດ, ສານພິດແລະຊ່ວຍໃຫ້ເລືອດປະກອບເປັນກ້າມຢູ່ບ່ອນທີ່ເປັນບາດແຜເປີດ.
ໜ້າ ທີ່ສັນຍານຂອງໂປຣຕີນແມ່ນການສົ່ງສັນຍານ (ຂໍ້ມູນ) ລະຫວ່າງຈຸລັງ.
ໂປຣຕີນປົກກະຕິ ສຳ ລັບຜູ້ໃຫຍ່
ຄວາມຕ້ອງການຂອງຮ່າງກາຍມະນຸດ ສຳ ລັບທາດໂປຼຕີນໂດຍກົງແມ່ນຂື້ນກັບກິດຈະ ກຳ ທາງດ້ານຮ່າງກາຍຂອງມັນ. ເມື່ອພວກເຮົາເຄື່ອນໄຫວຫຼາຍເທົ່າໃດ, ມັນກໍ່ຈະມີປະຕິກິລິຍາທາງຊີວະເຄມີຢ່າງໄວວາຢູ່ໃນຮ່າງກາຍຂອງພວກເຮົາ. ຄົນທີ່ອອກ ກຳ ລັງກາຍເປັນປະ ຈຳ ຕ້ອງການໂປຣຕີນເກືອບ 2 ເທົ່າຂອງຄົນທົ່ວໄປ. ການຂາດທາດໂປຼຕີນ ສຳ ລັບຄົນທີ່ກ່ຽວຂ້ອງກັບກິລາເປັນອັນຕະລາຍທີ່“ ເຮັດໃຫ້ກ້າມຊີ້ນແຫ້ງແລະ ໝົດ ແຮງຂອງຮ່າງກາຍ!”
ໂດຍສະເລ່ຍແລ້ວ, ມາດຕະຖານຂອງທາດໂປຼຕີນ ສຳ ລັບຜູ້ໃຫຍ່ແມ່ນຄິດໄລ່ບົນພື້ນຖານຂອງຕົວຄູນຂອງທາດໂປຼຕີນ 1 g ຕໍ່ 1 ກິໂລຂອງນ້ ຳ ໜັກ, ນັ້ນແມ່ນປະມານ 80-100 g ສຳ ລັບຜູ້ຊາຍ, 55-60 g ສຳ ລັບແມ່ຍິງ. ນັກກິລາຊາຍຖືກແນະ ນຳ ໃຫ້ເພີ່ມປະລິມານທາດໂປຼຕີນທີ່ບໍລິໂພກເຖິງ 170-200 g ຕໍ່ມື້.

ໂພຊະນາການທາດໂປຼຕີນທີ່ ເໝາະ ສົມຕໍ່ຮ່າງກາຍ
ໂພຊະນາການທີ່ ເໝາະ ສົມເພື່ອເຮັດໃຫ້ຮ່າງກາຍອີ່ມຕົວດ້ວຍທາດໂປຼຕີນແມ່ນການລວມຕົວຂອງໂປຣຕີນສັດແລະພືດ. ລະດັບຂອງການສົມທຽບທາດໂປຼຕີນຈາກອາຫານແມ່ນຂື້ນກັບຕົ້ນ ກຳ ເນີດແລະວິທີການຮັກສາຄວາມຮ້ອນ.
ດັ່ງນັ້ນ, ປະມານ 80% ຂອງການໄດ້ຮັບທາດໂປຼຕີນຈາກສັດແລະ 60% ຂອງທາດໂປຼຕີນຈາກຜັກແມ່ນຖືກດູດຊຶມຈາກຮ່າງກາຍ. ຜະລິດຕະພັນຕົ້ນ ກຳ ເນີດຂອງສັດມີທາດໂປຼຕີນຫຼາຍກ່ວາ ໜຶ່ງ ໜ່ວຍ ມວນສານຂອງຜະລິດຕະພັນຫຼາຍກວ່າໃນຜັກ. ນອກຈາກນັ້ນ, ສ່ວນປະກອບຂອງຜະລິດຕະພັນ "ສັດ" ປະກອບມີອາຊິດ amino ທັງ ໝົດ, ແລະຜະລິດຕະພັນພືດໃນເລື່ອງນີ້ຖືວ່າຕໍ່າກວ່າ.
ກົດລະບຽບດ້ານໂພຊະນາການຂັ້ນພື້ນຖານ ສຳ ລັບການດູດຊຶມທາດໂປຼຕີນທີ່ດີຂື້ນ:
- ວິທີການປຸງແຕ່ງອາຫານທີ່ອ່ອນໂຍນ - ປຸງແຕ່ງອາຫານ, ໜື້ງ, ໜຽວ. ການຈືນຄວນຖືກປະຕິເສດ.
- ແນະ ນຳ ໃຫ້ກິນປາແລະສັດປີກຫຼາຍກວ່າເກົ່າ. ຖ້າທ່ານຕ້ອງການຊີ້ນແທ້ໆ, ເລືອກຊີ້ນງົວ.
- ອາຫານເສີມຄວນໄດ້ຮັບການຍົກເວັ້ນຈາກອາຫານ, ພວກມັນແມ່ນໄຂມັນແລະເປັນອັນຕະລາຍ. ໃນກໍລະນີຮ້າຍແຮງທີ່ສຸດ, ທ່ານສາມາດແຕ່ງອາຫານເຍື່ອງ ທຳ ອິດໂດຍ ນຳ ໃຊ້ "ເຂົ້າ ໜົມ ປັງຮອງ".
ຄຸນລັກສະນະຂອງທາດ ບຳ ລຸງທາດໂປຼຕີນ ສຳ ລັບການເຕີບໃຫຍ່ຂອງກ້າມເນື້ອ
ນັກກິລາທີ່ໄດ້ຮັບກ້າມເນື້ອຢ່າງຫ້າວຫັນຄວນປະຕິບັດຕາມ ຄຳ ແນະ ນຳ ທັງ ໝົດ ຂ້າງເທິງ. ອາຫານຂອງພວກມັນສ່ວນໃຫຍ່ຄວນຈະເປັນໂປຣຕີນຂອງຕົ້ນ ກຳ ເນີດຂອງສັດ. ພວກເຂົາຄວນກິນໂດຍສົມທົບກັບຜະລິດຕະພັນໂປຕີນຜັກ, ໃນນັ້ນຖົ່ວເຫຼືອງແມ່ນຄວາມມັກໂດຍສະເພາະ.
ມັນຍັງມີຄວາມ ຈຳ ເປັນທີ່ຈະຕ້ອງປຶກສາທ່ານ ໝໍ ແລະພິຈາລະນາ ນຳ ໃຊ້ເຄື່ອງດື່ມທາດໂປຼຕີນພິເສດ, ອັດຕາສ່ວນຂອງການດູດຊຶມທາດໂປຼຕີນຈາກນັ້ນແມ່ນ 97–98%. ຜູ້ຊ່ຽວຊານຈະເລືອກເຄື່ອງດື່ມ, ຄິດໄລ່ປະລິມານທີ່ຖືກຕ້ອງ. ນີ້ຈະເປັນການເສີມທາດໂປຼຕີນທີ່ເປັນປະໂຫຍດແລະເປັນປະໂຫຍດຕໍ່ການຝຶກອົບຮົມຄວາມເຂັ້ມແຂງ.
ການປະຕິເສດ
denaturation ທາດໂປຼຕີນແມ່ນຫມາຍເຖິງການປ່ຽນແປງໃດໆໃນກິດຈະກໍາທາງຊີວະພາບແລະ / ຫຼືຄຸນລັກສະນະທາງກາຍະພາບທີ່ກ່ຽວຂ້ອງກັບການສູນເສຍໂຄງສ້າງທາງດ້ານ quaternary, ຂັ້ນສາມຫຼືຂັ້ນສອງ (ເບິ່ງໃນສ່ວນ“ ໂຄງສ້າງທາດໂປຼຕີນ”). ຕາມກົດລະບຽບ, ທາດໂປຼຕີນແມ່ນຂ້ອນຂ້າງຂ້ອນຂ້າງພາຍໃຕ້ເງື່ອນໄຂເຫຼົ່ານີ້ (ອຸນຫະພູມ, pH, ແລະອື່ນໆ) ເຊິ່ງພວກມັນເຮັດວຽກຢູ່ໃນຮ່າງກາຍ. ການປ່ຽນແປງທີ່ຮຸນແຮງໃນສະພາບການເຫຼົ່ານີ້ເຮັດໃຫ້ເກີດການຂາດທາດໂປຼຕີນ. ອີງຕາມລັກສະນະຂອງຕົວແທນ denaturing, ກົນຈັກ (ກະຕຸ້ນຫຼືສັ່ນ), ຮ່າງກາຍ (ຄວາມຮ້ອນ, ຄວາມເຢັນ, ການລະລາຍ, sonication) ແລະສານເຄມີ (ອາຊິດແລະເປັນດ່າງ, surfactants, urea) denaturation ແມ່ນແຕກຕ່າງກັນ.
denaturation ທາດໂປຼຕີນສາມາດສົມບູນຫລືບາງສ່ວນ, ປີ້ນກັບກັນຫຼືບໍ່ປ່ຽນແປງໄດ້. ກໍລະນີທີ່ມີຊື່ສຽງທີ່ສຸດຂອງການລະງັບທາດໂປຼຕີນທີ່ບໍ່ປ່ຽນແປງໄດ້ໃນຊີວິດປະ ຈຳ ວັນແມ່ນການກະກຽມໄຂ່ໄກ່, ໃນເວລາທີ່ຢູ່ພາຍໃຕ້ອິດທິພົນຂອງອຸນຫະພູມສູງ, ທາດໂປຼຕີນຈາກ ovalbumin ໂປ່ງໃສທີ່ລະລາຍໃນນໍ້າກາຍເປັນຄວາມ ໜາ ແໜ້ນ, ບໍ່ລະລາຍແລະເປື້ອນ. ການປະຕິເສດໃນບາງກໍລະນີແມ່ນປີ້ນກັບກັນ, ໃນກໍລະນີທີ່ມີຝົນຕົກໃນລະດັບທາດໂປຼຕີນທີ່ລະລາຍໃນນໍ້າໂດຍໃຊ້ເກືອອາໂມນຽມ (ເກືອອອກວິທີການ), ແລະວິທີການນີ້ຖືກໃຊ້ເປັນວິທີການ ທຳ ຄວາມສະອາດພວກມັນ.
ໂມເລກຸນທາດໂປຼຕີນແມ່ນໂພລິເມີເສັ້ນທີ່ປະກອບດ້ວຍສານຕົກຄ້າງຂອງອາຊິດ amino-L-amino (ເຊິ່ງເປັນໂມໂມເມີ), ແລະຍັງມີການປ່ຽນແປງສິ່ງເສດເຫຼືອຂອງກົດອາມີໂນແລະສ່ວນປະກອບຂອງ ທຳ ມະຊາດທີ່ບໍ່ແມ່ນກົດ amino ສາມາດລວມເຂົ້າໃນສ່ວນປະກອບຂອງໂປຣຕີນ. ໃນວັນນະຄະດີວິທະຍາສາດ, ຕົວອັກສອນຫຍໍ້ ໜຶ່ງ ຫລືສາມຕົວຖືກໃຊ້ເພື່ອ ໝາຍ ເຖິງອາຊິດ amino. ເຖິງແມ່ນວ່າໃນເວລາທີ່ເບິ່ງ ທຳ ອິດມັນອາດເບິ່ງຄືວ່າການໃຊ້ອາຊິດ amino ໃນ 20 ຊະນິດເທົ່ານັ້ນໃນໂປຣຕີນສ່ວນໃຫຍ່ ຈຳ ກັດຄວາມຫຼາກຫຼາຍຂອງໂຄງສ້າງທາດໂປຼຕີນ, ໃນຕົວຈິງ, ຈຳ ນວນຕົວເລືອກທີ່ບໍ່ສາມາດຄາດເດົາໄດ້: ສຳ ລັບລະບົບຕ່ອງໂສ້ຂອງເສດອາຊິດ amino 5 ຊະນິດ, ມັນມີຢູ່ແລ້ວຫຼາຍກ່ວາ 3 ລ້ານ, (ທາດໂປຼຕີນຂະຫນາດນ້ອຍ) ສາມາດເປັນຕົວແທນໃນຫຼາຍກວ່າ 10,130 ຕົວແປ. ທາດໂປຼຕີນຈາກ 2 ຫາຫລາຍສິບຫລາຍໆສ່ວນຂອງສານອາຊິດ amino ໃນຄວາມຍາວມັກຖືກເອີ້ນ peptides, ມີລະດັບຫຼາຍກວ່າເກົ່າຂອງ polymerization - ກະຮອກ, ເຖິງແມ່ນວ່າການແບ່ງງານນີ້ມີຫຼາຍຢ່າງທີ່ຕົນເອງມັກ.
ໃນເວລາທີ່ທາດໂປຼຕີນຖືກສ້າງຕັ້ງຂຶ້ນເປັນຜົນມາຈາກການປະຕິສໍາພັນຂອງກຸ່ມ car-carboxyl (-COOH) ຂອງອາຊິດ amino ຫນຶ່ງກັບກຸ່ມ amino-amino (NH)2) ຂອງອາຊິດ amino ອື່ນ, ພັນທະບັດ peptide ຖືກສ້າງຕັ້ງຂຶ້ນ. ສ່ວນທີ່ສຸດຂອງທາດໂປຼຕີນແມ່ນເອີ້ນວ່າ N- ແລະ C-terminus, ເຊິ່ງຂື້ນກັບກຸ່ມໃດຂອງກຸ່ມອາຊິດ amino ຢູ່ປາຍຍອດແມ່ນບໍ່ເສຍຄ່າ: -NH2 ຫຼື -COOH, ຕາມ ລຳ ດັບ. ໃນການສັງເຄາະທາດໂປຼຕີນໃນກະດູກສັນຫຼັງ, ສານເສດເຫຼືອອາຊິດ amino ຊະນິດ ທຳ ອິດ (N-terminal) ປົກກະຕິແລ້ວແມ່ນສານເສດເຫຼືອ methionine, ແລະສານຕົກຄ້າງຕໍ່ໆມາແມ່ນຕິດກັບ C-terminus ຂອງທີ່ຜ່ານມາ.
ຄຸນລັກສະນະຂອງທາດ ບຳ ລຸງທາດໂປຼຕີນ, ອາຫານການກິນ
ຜູ້ທີ່ຕ້ອງການຫຼຸດນ້ ຳ ໜັກ ຄວນກິນຜະລິດຕະພັນໂປຕີນຈາກສັດແລະຜັກ. ມັນເປັນສິ່ງ ສຳ ຄັນທີ່ຈະແຍກການໄດ້ຮັບຂອງພວກເຂົາ, ເພາະວ່າເວລາ ສຳ ລັບການຮັບຮອງຂອງພວກເຂົາແມ່ນແຕກຕ່າງກັນ. ຜະລິດຕະພັນຊີ້ນທີ່ມີໄຂມັນຄວນຈະຖືກຍົກເລີກ, ມັນຕົ້ນບໍ່ຄວນຖືກທາລຸນ, ເມັດທັນຍາພືດທີ່ມີເນື້ອໃນໂປຕີນສະເລ່ຍຄວນຈະເປັນທີ່ນິຍົມ.
ຢ່າໄປຫາທີ່ສຸດແລະ "ນັ່ງ" ກ່ຽວກັບອາຫານໂປຕີນ. ມັນບໍ່ເຫມາະສົມກັບທຸກໆຄົນ, ເພາະວ່າການຍົກເວັ້ນທາດແປ້ງທີ່ສົມບູນຈະເຮັດໃຫ້ຄວາມສາມາດໃນການເຮັດວຽກແລະພະລັງງານຫຼຸດລົງ. ມັນພຽງພໍທີ່ຈະກິນອາຫານທີ່ມີຄາໂບໄຮເດຣດໃນຕອນເຊົ້າ - ສິ່ງນີ້ຈະຊ່ວຍໃຫ້ພະລັງງານໃນຕອນກາງເວັນ, ຕອນບ່າຍ, ກິນອາຫານທີ່ມີໂປຣຕີນທາດໂປຼຕີນຕໍ່າ. ເພື່ອເຮັດໃຫ້ຂາດພະລັງງານໃນຕອນແລງ, ຮ່າງກາຍຈະເລີ່ມເຜົາຜານໄຂມັນໃນຮ່າງກາຍ, ເຖິງຢ່າງໃດກໍ່ຕາມ, ຂະບວນການນີ້ຈະປອດໄພຕໍ່ສຸຂະພາບຂອງຮ່າງກາຍ.
ໃຫ້ແນ່ໃຈວ່າຈະລວມເອົາອາຫານໂປຕີນທີ່ຖືກກະກຽມແລະຖືກຕ້ອງໃນອາຫານຂອງທ່ານ. ສຳ ລັບຮ່າງກາຍ, ທາດໂປຼຕີນແມ່ນວັດສະດຸກໍ່ສ້າງຫຼັກ! ຮ່ວມກັບການຝຶກເປັນປະ ຈຳ, ມັນຈະຊ່ວຍໃຫ້ທ່ານສ້າງຮ່າງກາຍຂອງນັກກິລາທີ່ສວຍງາມ!
ທາດໂປຼຕີນແມ່ນສານເຄມີທີ່ ສຳ ຄັນທີ່ສຸດ, ໂດຍບໍ່ມີກິດຈະ ກຳ ທີ່ ສຳ ຄັນຂອງຮ່າງກາຍຈະເປັນໄປບໍ່ໄດ້. ທາດໂປຼຕີນປະກອບດ້ວຍ enzymes, ຈຸລັງຂອງອະໄວຍະວະ, ແພຈຸລັງ. ພວກເຂົາຮັບຜິດຊອບກ່ຽວກັບທາດແປ້ງ, ການຂົນສົ່ງແລະຫຼາຍໆຂະບວນການອື່ນໆທີ່ເກີດຂື້ນໃນຮ່າງກາຍຂອງມະນຸດ. ທາດໂປຼຕີນບໍ່ສາມາດສະສົມ“ ໄວ້ໃນຄັງ ສຳ ຮອງ”, ສະນັ້ນພວກມັນຕ້ອງໄດ້ກິນເປັນປະ ຈຳ. ພວກມັນມີຄວາມ ສຳ ຄັນໂດຍສະເພາະ ສຳ ລັບຄົນທີ່ກ່ຽວຂ້ອງກັບກິລາ, ເພາະວ່າໂປຣຕີນແມ່ນຖືກຄວບຄຸມ.
ລະດັບອົງກອນ

K. Lindstrom-Lang ສະ ເໜີ ໃຫ້ແຍກ 4 ລະດັບຂອງການຈັດຕັ້ງໂຄງສ້າງຂອງໂປຣຕີນ: ໂຄງສ້າງປະຖົມ, ມັດທະຍົມ, ຂັ້ນສາມແລະໄຕ. ເຖິງແມ່ນວ່າການແບ່ງງານນີ້ແມ່ນລ້າສະ ໄໝ ບາງຢ່າງ, ແຕ່ມັນຍັງສືບຕໍ່ ນຳ ໃຊ້ຢູ່. ໂຄງສ້າງຕົ້ນຕໍ (ລຳ ດັບຂອງການຕົກຄ້າງຂອງອາຊິດ amino) ຂອງ polypeptide ແມ່ນຖືກ ກຳ ນົດໂດຍໂຄງສ້າງຂອງລະຫັດພັນທຸ ກຳ ແລະລະຫັດພັນທຸ ກຳ ຂອງມັນ, ແລະໂຄງສ້າງຂອງ ຄຳ ສັ່ງທີ່ສູງກວ່າແມ່ນຖືກສ້າງຕັ້ງຂື້ນໃນຂັ້ນຕອນການພັບທາດໂປຼຕີນ. ເຖິງແມ່ນວ່າໂຄງປະກອບຂອງພື້ນທີ່ຂອງໂປຣຕີນທັງ ໝົດ ຈະຖືກ ກຳ ນົດໂດຍ ລຳ ດັບອາຊິດ amino ຂອງມັນ, ມັນຂ້ອນຂ້າງຂ້ອນຂ້າງ labile ແລະອາດຈະຂື້ນກັບສະພາບພາຍນອກ, ສະນັ້ນມັນຈຶ່ງຖືກຕ້ອງກວ່າທີ່ຈະເວົ້າກ່ຽວກັບຄວາມສອດຄ່ອງຂອງໂປຼຕີນທີ່ມັກຫຼືແຂງແຮງທີ່ສຸດ.
ໂຄງສ້າງປະຖົມ

ໂຄງສ້າງຕົ້ນຕໍແມ່ນ ລຳ ດັບຂອງອາຊິດ amino ທີ່ຢູ່ໃນລະບົບຕ່ອງໂສ້ polypeptide. ໂຄງສ້າງຕົ້ນຕໍຂອງທາດໂປຼຕີນແມ່ນຖືກອະທິບາຍໂດຍປົກກະຕິໂດຍໃຊ້ການອອກແບບຕົວອັກສອນດຽວຫຼືສາມຕົວ ສຳ ລັບການຕົກຄ້າງຂອງກົດອະມິໂນ.
ລັກສະນະທີ່ ສຳ ຄັນຂອງໂຄງສ້າງຕົ້ນຕໍແມ່ນຮູບແຕ້ມແບບອະນຸລັກ - ການປະສົມສານອາຊິດ amino ທີ່ມີຄວາມສົມດຸນທີ່ ໝັ້ນ ຄົງເຊິ່ງເຮັດ ໜ້າ ທີ່ທີ່ແນ່ນອນແລະພົບໃນໂປຣຕີນຫຼາຍ. ຮູບແຕ້ມແບບອະນຸລັກຖືກຮັກສາໄວ້ໃນໄລຍະວິວັດທະນາການຂອງຊະນິດພັນ; ມັນເປັນໄປໄດ້ທີ່ຈະຄາດຄະເນການເຮັດວຽກຂອງໂປຣຕີນທີ່ບໍ່ຮູ້ຈັກຈາກພວກມັນ. ລະດັບຂອງການ homism (ຄວາມຄ້າຍຄືກັນ) ຂອງລໍາດັບທາດອາຊິດ amino ຂອງທາດໂປຼຕີນຂອງອົງການຈັດຕັ້ງທີ່ແຕກຕ່າງກັນສາມາດຖືກນໍາໃຊ້ເພື່ອປະເມີນໄລຍະທາງວິວັດທະນາການລະຫວ່າງພາສີທີ່ສັດເຫຼົ່ານີ້ເປັນຂອງ.
ໂຄງສ້າງຫລັກຂອງໂປຣຕີນສາມາດຖືກ ກຳ ນົດໂດຍວິທີການຈັດລຽງ ລຳ ດັບໂປຣຕີນຫລືໂດຍໂຄງສ້າງຫລັກຂອງ mRNA ຂອງມັນໂດຍ ນຳ ໃຊ້ຕາຕະລາງລະຫັດພັນທຸ ກຳ.
ໂຄງປະກອບຂັ້ນສອງ
ໂຄງປະກອບຂັ້ນສອງແມ່ນການຈັດລຽງລໍາດັບທ້ອງຖິ່ນຂອງຊິ້ນສ່ວນຂອງລະບົບຕ່ອງໂສ້ polypeptide ທີ່ສະຖຽນລະພາບໂດຍພັນທະບັດໄຮໂດເຈນ.ຕໍ່ໄປນີ້ແມ່ນປະເພດທົ່ວໄປທີ່ສຸດຂອງໂຄງສ້າງທາດໂປຼຕີນຂັ້ນສອງ:
- ices- ໝວກ ກັນກະທົບມີຄວາມ ໜາ ແໜ້ນ ຮອບແກນຍາວຂອງໂມເລກຸນ. ລ້ຽວຄັ້ງ ໜຶ່ງ ແມ່ນສານຕົກຄ້າງຂອງກົດອະມິໂນມີ 3,6 ລິດ, ສ່ວນຂອງກີລາເຮລິຄອບເຕີແມ່ນ 0,54 nm (0,15 nm ຕົກລົງ 1 ສ່ວນຂອງທາດອາຊິດ amino). ກ້ຽວວຽນຖືກສະຖຽນລະພາບໂດຍພັນທະບັດໄຮໂດເຈນລະຫວ່າງກຸ່ມ peptide H ແລະ O, ຫ່າງກັນ 4 ໜ່ວຍ. ເຖິງແມ່ນວ່າ hel-helix ສາມາດເປັນທັງມືຊ້າຍຫລືຂວາ, ສ່ວນເບື້ອງຂວາກໍ່ຈະມີໂປຣຕີນຫຼາຍ. ກ້ຽວວຽນຖືກລົບກວນຈາກການປະຕິ ສຳ ພັນທາງອິເລັກໂທຣນິກຂອງກົດ glutamic, lysine, arginine. ຢູ່ໃກ້ກັນແລະກັນ, ສານ asparagine, serine, threonine ແລະ leucine ສາມາດແຊກແຊງເປັນປົກກະຕິກັບການສ້າງ helix, ສ່ວນທີ່ເຫຼືອຂອງ proline ເຮັດໃຫ້ເກີດການຕ່ອງໂສ້ແລະຍັງເຮັດໃຫ້ເກີດຄວາມເສຍຫາຍຕໍ່α-helices,
- ແຜ່ນ ((ຊັ້ນພັບ) ແມ່ນຕ່ອງໂສ້ polypeptide ຫຼາຍກ່ວາ zigzag ເຊິ່ງໃນນັ້ນພັນທະບັດໄຮໂດຼລິກຖືກສ້າງຕັ້ງຂື້ນລະຫວ່າງກົດອະມິໂນທີ່ຂ້ອນຂ້າງຂ້ອນຂ້າງ (0.34 nm ຕໍ່ອາຊິດ amino ທີ່ຢູ່) ໃນໂຄງສ້າງຕົ້ນຕໍຫຼືຕ່ອງໂສ້ທາດໂປຼຕີນທີ່ແຕກຕ່າງກັນ (ຫຼາຍກ່ວາສະຖານທີ່ໃກ້ຊິດ, ເຊັ່ນດຽວກັບກໍລະນີ ຢູ່ໃນα-helix). ລະບົບຕ່ອງໂສ້ເຫຼົ່ານີ້ມັກຈະຖືກມຸ້ງໄປທາງ N-ປາຍໄປໃນທິດທາງກົງກັນຂ້າມ (ການ ກຳ ນົດທິດທາງກົງກັນຂ້າມ) ຫຼືໃນທິດທາງດຽວກັນ (ຂະ ໜານ structure ໂຄງສ້າງ). ມັນຍັງເປັນໄປໄດ້ທີ່ມີຢູ່ຂອງໂຄງສ້າງປະສົມβທີ່ປະກອບດ້ວຍໂຄງສ້າງຂະຫນານແລະ antiparallel. ສຳ ລັບການສ້າງເອກະສານβ, ຂະ ໜາດ ນ້ອຍໆຂອງກຸ່ມຂ້າງຂອງອາຊິດ amino ແມ່ນມີຄວາມ ສຳ ຄັນ, ໂດຍປົກກະຕິແລ້ວແມ່ນ glycine ແລະ alanine,
- π-helix
- 310ກ້ຽວວຽນ
- ຊິ້ນສ່ວນທີ່ບໍ່ມີຂອບເຂດ.
ໂຄງປະກອບຊັ້ນສູງ

ໂຄງປະກອບຂັ້ນສູງແມ່ນໂຄງສ້າງທາງກວ້າງຂອງຕ່ອງໂສ້ polypeptide. ໂຄງປະກອບ, ມັນປະກອບດ້ວຍອົງປະກອບຂອງໂຄງສ້າງຂັ້ນສອງທີ່ສະຖຽນລະພາບໂດຍປະເພດຕ່າງໆຂອງການໂຕ້ຕອບເຊິ່ງການປະຕິ ສຳ ພັນ hydrophobic ມີບົດບາດ ສຳ ຄັນ. ສະຖຽນລະພາບຂອງໂຄງປະກອບຂັ້ນສາມກ່ຽວຂ້ອງກັບ:
- ພັນທະບັດ covalent (ລະຫວ່າງສອງ cysteine ຕົກຄ້າງ - ຂົວ disulfide),
- ພັນທະບັດ ionic ລະຫວ່າງກຸ່ມຂ້າງທີ່ຖືກຄິດໄລ່ກົງກັນຂ້າມກັບການຕົກຄ້າງຂອງອາຊິດ amino,
- ພັນທະບັດໄຮໂດຼລິກ
- ປະຕິ ສຳ ພັນທາງນ້ ຳ. ເມື່ອພົວພັນກັບໂມເລກຸນນ້ ຳ ທີ່ຢູ່ອ້ອມຂ້າງ, ໂມເລກຸນທາດໂປຼຕີນຖືກພັບເພື່ອວ່າກຸ່ມຂ້າງທີ່ບໍ່ແມ່ນຂົ້ວຂອງອາຊິດ amino ແມ່ນແຍກອອກຈາກວິທີແກ້ໄຂທີ່ມີນ້ ຳ, ແລະກຸ່ມຂ້າງທີ່ຂົ້ວໂລກໃຕ້ຈະປາກົດຢູ່ເທິງ ໜ້າ ໂມເລກຸນ.
ການສຶກສາກ່ຽວກັບຫຼັກການຂອງການພັບທາດໂປຼຕີນໄດ້ສະແດງໃຫ້ເຫັນວ່າມັນສະດວກໃນການ ຈຳ ແນກອີກລະດັບ ໜຶ່ງ ລະຫວ່າງລະດັບຂອງໂຄງສ້າງຊັ້ນສອງແລະໂຄງສ້າງທາງອາກາດຂອງອະຕອມ - ລວດລາຍພັບ (ສະຖາປັດຕະຍະ ກຳ, ໂຄງສ້າງໂຄງສ້າງ). ຮູບແບບການອອກແບບແມ່ນຖືກ ກຳ ນົດໂດຍການຈັດສັນເຊິ່ງກັນແລະກັນຂອງອົງປະກອບໂຄງສ້າງຂັ້ນສອງ (hel-helices ແລະ nds-strands) ພາຍໃນໂດເມນໂປຣຕີນ - ໂລຫະປະສົມທີ່ສາມາດມີໄດ້ດ້ວຍຕົວມັນເອງຫລືເປັນສ່ວນ ໜຶ່ງ ຂອງທາດໂປຼຕີນໃຫຍ່ພ້ອມກັບໂດເມນອື່ນໆ. ຍົກຕົວຢ່າງ, ພິຈາລະນາ ໜຶ່ງ ໃນບັນດາລວດລາຍທີ່ມີລັກສະນະຂອງໂຄງສ້າງຂອງໂປຣຕີນ. ທາດໂປຼຕີນທົ່ວໂລກທີ່ສະແດງໃນຮູບເບື້ອງຂວາ, triose phosphatisomerase, ມີຮູບແຕ້ມພັບທີ່ເອີ້ນວ່າβ / βກະບອກ: ເສັ້ນຂະ ໜານ 8 ເສັ້ນຂະ ໜານ ປະກອບເປັນβກະບອກພາຍໃນກະບອກນ້ ຳ ອື່ນ, ປະກອບດ້ວຍ 8 ices-helices. ລວດລາຍນີ້ພົບໃນໂປຣຕີນປະມານ 10%.
ມັນແມ່ນເປັນທີ່ຮູ້ຈັກວ່າຮູບແບບຂອງຄໍເຕົ້າໄຂ່ແມ່ນຂ້ອນຂ້າງອະນຸລັກແລະຖືກພົບເຫັນຢູ່ໃນທາດໂປຼຕີນທີ່ບໍ່ມີສາຍພົວພັນທີ່ມີປະໂຫຍດແລະວິວັຖນາການ. ການ ກຳ ນົດສິ່ງລະດົມໃຈທີ່ມີລັກສະນະເປັນພື້ນຖານຂອງການຈັດປະເພດທາດໂປຼຕີນທາງຮ່າງກາຍ, ຫຼືສົມເຫດສົມຜົນ (ເຊັ່ນ CATH ຫຼື SCOP).
ເພື່ອ ກຳ ນົດໂຄງສ້າງທາງພູມສາດຂອງທາດໂປຼຕີນ, ວິທີການວິເຄາະຄວາມແຕກຕ່າງຂອງ x-ray, ຄວາມຕ້ານທານຂອງແມ່ເຫຼັກນິວເຄຼຍ, ແລະບາງກ້ອງຈຸລະທັດປະເພດຕ່າງໆຖືກ ນຳ ໃຊ້.
ໂຄງປະກອບ Quaternary
ໂຄງສ້າງ quaternary (ຫຼື subunit, ໂດເມນ) ແມ່ນການຈັດການເຊິ່ງກັນແລະກັນຂອງຫຼາຍໆຕ່ອງໂສ້ polypeptide ໃນສະລັບສັບຊ້ອນໂປຣຕີນດຽວ.ໂມເລກຸນທາດໂປຼຕີນທີ່ປະກອບທາດໂປຼຕີນທີ່ມີໂຄງສ້າງ quaternary ໄດ້ຖືກສ້າງຕັ້ງຂື້ນແຍກຕ່າງຫາກກ່ຽວກັບ ribosomes ແລະພຽງແຕ່ຫຼັງຈາກສິ້ນສຸດຂອງການສັງເຄາະພວກມັນກໍ່ສ້າງໂຄງປະກອບ supramolecular ທົ່ວໄປ. ທາດໂປຼຕີນຈາກ quaternary ສາມາດປະກອບມີທັງຕ່ອງໂສ້ polypeptide ດຽວກັນແລະແຕກຕ່າງກັນ. ສະຖຽນລະພາບຂອງໂຄງສ້າງ Quaternary ກ່ຽວຂ້ອງກັບປະເພດການໂຕ້ຕອບແບບດຽວກັນກັບໃນສະຖຽນລະພາບຂອງ Tertiary. ສະລັບສັບຊ້ອນທາດໂປຼຕີນຈາກ Supramolecular ສາມາດປະກອບດ້ວຍໂມເລກຸນຫຼາຍສິບ.
ການຈັດປະເພດຕາມປະເພດອາຄານ
ອີງຕາມປະເພດໂຄງສ້າງທົ່ວໄປ, ທາດໂປຼຕີນສາມາດແບ່ງອອກເປັນສາມກຸ່ມ:
- ທາດໂປຼຕີນຈາກ Fibrillar - ຮູບແບບໂພລີເມີ, ໂຄງປະກອບຂອງພວກມັນແມ່ນປົກກະຕິສູງແລະໄດ້ຮັບການສະ ໜັບ ສະ ໜູນ ສ່ວນໃຫຍ່ຈາກການພົວພັນລະຫວ່າງຕ່ອງໂສ້ທີ່ແຕກຕ່າງກັນ. ພວກມັນປະກອບເປັນ microfilaments, microtubules, fibrils, ແລະສະ ໜັບ ສະ ໜູນ ໂຄງສ້າງຂອງຈຸລັງແລະແພຈຸລັງ. ທາດໂປຼຕີນຈາກ Fibrillar ປະກອບມີ keratin ແລະ collagen.
- ທາດໂປຼຕີນທົ່ວໂລກແມ່ນລະລາຍໃນນ້ ຳ, ຮູບແບບທົ່ວໄປຂອງໂມເລກຸນແມ່ນມີຫຼາຍຫຼື ໜ້ອຍ.
- ທາດໂປຼຕີນຈາກ Membrane - ມີໂດເມນທີ່ຕັດກັນຂອງເຍື່ອຫ້ອງ, ແຕ່ວ່າບາງສ່ວນຂອງມັນ protrude ຈາກເຍື່ອເຂົ້າໄປໃນສະພາບແວດລ້ອມ intercellular ແລະ cytoplasm ຂອງເຊນ. ໂປຣຕີນ Membrane ເຮັດ ໜ້າ ທີ່ເປັນຕົວຮັບ, ນັ້ນຄື, ພວກມັນສົ່ງສັນຍານ, ແລະຍັງສະ ໜອງ ການຂົນສົ່ງຂອງສານຕ່າງໆ. ຜູ້ຂົນສົ່ງທາດໂປຼຕີນແມ່ນສະເພາະ, ພວກມັນແຕ່ລະຄົນຈະຜ່ານເຍື່ອພຽງແຕ່ໂມເລກຸນຫຼືສັນຍານບາງປະເພດເທົ່ານັ້ນ.
ທາດໂປຼຕີນທີ່ງ່າຍດາຍແລະສັບສົນ
ນອກເຫນືອໄປຈາກຕ່ອງໂສ້ peptide, ທາດໂປຼຕີນຫຼາຍຍັງປະກອບດ້ວຍກຸ່ມອາຊິດທີ່ບໍ່ແມ່ນ amino, ແລະໂດຍທາດໂປຼຕີນຈາກເກນນີ້ຖືກແບ່ງອອກເປັນສອງກຸ່ມໃຫຍ່ - ທາດໂປຼຕີນທີ່ງ່າຍດາຍແລະສັບຊ້ອນ (ທາດໂປຼຕີນ). ທາດໂປຼຕີນທີ່ງ່າຍດາຍປະກອບມີພຽງແຕ່ຕ່ອງໂສ້ polypeptide, ທາດໂປຼຕີນທີ່ສັບສົນຍັງມີອາຊິດທີ່ບໍ່ແມ່ນ amino, ຫຼືທຽມ, ກຸ່ມ. ອີງຕາມລັກສະນະທາງເຄມີຂອງກຸ່ມທຽມ, ຫ້ອງຮຽນຕໍ່ໄປນີ້ຈະຖືກ ຈຳ ແນກໃນບັນດາໂປຣຕີນທີ່ສັບສົນ:
- Glycoproteins ບັນຈຸທາດຄາໂບໄຮເດຣດທີ່ເຊື່ອມໂຍງໂດຍສ່ວນປະກອບເປັນກຸ່ມທຽມ, glycoproteins ບັນຈຸສານຕົກຄ້າງທີ່ມີສານ mucopolysaccharide ເປັນຂອງກຸ່ມຍ່ອຍຂອງໂປຣຕິນ. ກຸ່ມ Hydroxyl ຂອງ serine ຫຼື threonine ມັກຈະມີສ່ວນຮ່ວມໃນການສ້າງຄວາມຜູກພັນກັບທາດເສດທາດຄາໂບໄຮເດຣດ. ທາດໂປຼຕີນທີ່ຖືກຍົກເລີກຫຼາຍທີ່ສຸດ, ໂດຍສະເພາະ immunoglobulins, ແມ່ນ glycoproteins. ໃນ proteoglycans, ສ່ວນຂອງທາດແປ້ງແມ່ນ
95% ຂອງມວນທັງ ໝົດ ຂອງໂມເລກຸນທາດໂປຼຕີນ, ພວກມັນແມ່ນສ່ວນປະກອບຫຼັກຂອງໂມເລກຸນ intercellular,
2. ຄວາມ ສຳ ຄັນທາງຊີວະພາບຂອງການສືບພັນຂອງສິ່ງມີຊີວິດ. ວິທີການຂອງການສືບພັນ.
1. ການສືບພັນແລະຄວາມ ສຳ ຄັນຂອງມັນ.
ການແຜ່ພັນ - ການແຜ່ພັນຂອງສິ່ງມີຊີວິດທີ່ຄ້າຍຄືກັນ, ເຊິ່ງສະ ໜອງ
ຄວາມເປັນຢູ່ຂອງຊະນິດພັນໃນຫຼາຍພັນປີໄດ້ປະກອບສ່ວນເຂົ້າໃນການເພີ່ມຂື້ນຂອງສັດ
ຈໍານວນຂອງບຸກຄົນຂອງຊະນິດພັນ, ການສືບຕໍ່ຂອງຊີວິດ. ເພດ, ເພດແລະ
ການຂະຫຍາຍພັນແບບອະໄວຍະວະຂອງສິ່ງມີຊີວິດ.
2. ການສືບພັນຂອງເພດຍິງແມ່ນວິທີທີ່ເກົ່າແກ່ທີ່ສຸດ. ໃນ
ໜຶ່ງ ອົງການ ໜຶ່ງ ມີສ່ວນຮ່ວມໃນການມີເພດ ສຳ ພັນ, ໃນຂະນະທີ່ສ່ວນຫຼາຍມັກມີສ່ວນຮ່ວມໃນເພດ
ສອງຄົນ. ໃນພືດ, ການສືບພັນແບບບໍ່ມີສາຍໂດຍໃຊ້ spores - ໜຶ່ງ
ຈຸລັງພິເສດ. ການຂະຫຍາຍພັນໂດຍ spores ຂອງ algae, moss, horsetail,
ໂຈນ, ຜັກກູດ. ຜື່ນຂອງ spores ຈາກພືດ, ການແຕກງອກແລະການພັດທະນາຂອງມັນ
ພວກມັນມີສັດລ້ຽງ ໃໝ່ ໃນສະພາບທີ່ເອື້ອ ອຳ ນວຍ. ການເສຍຊີວິດຂອງຈໍານວນຫຼວງຫຼາຍ
ການຖົກຖຽງຕົກເຂົ້າສູ່ສະພາບການທີ່ບໍ່ດີ. ຄວາມເປັນໄປໄດ້ຕໍ່າຂອງການປະກົດຕົວ
ບັນດາສິ່ງມີຊີວິດ ໃໝ່ ທີ່ມາຈາກ spores ເພາະມັນມີສານອາຫານແລະ
ເບ້ຍໄມ້ດູດເອົາຕົ້ນຕໍຈາກສິ່ງແວດລ້ອມ.
3. ການຂະຫຍາຍພັນແບບອະເພດ - ການຂະຫຍາຍພັນຂອງພືດກັບ
ການ ນຳ ໃຊ້ອະໄວຍະວະ ບຳ ລຸງລ້ຽງ: ຍອດທາງອາກາດຫລືໃຕ້ດິນ, ສ່ວນຂອງຮາກ,
ໃບ, ຫົວ, ຫລອດໄຟ. ການມີສ່ວນຮ່ວມໃນການຂະຫຍາຍພັນແບບອະໄວຍະວະຂອງອະໄວຍະວະ ໜຶ່ງ
ຫຼືພາກສ່ວນຂອງມັນ. ຄວາມຜູກພັນຂອງລູກສາວປູກກັບແມ່, ຄືກັບມັນ
ສືບຕໍ່ການພັດທະນາຂອງຮ່າງກາຍຂອງແມ່. ປະສິດທິພາບດີແລະ
ການແຜ່ກະຈາຍຂອງການຂະຫຍາຍພັນແບບອະໄວຍະວະໃນ ທຳ ມະຊາດ, ເປັນອົງການຍ່ອຍ
ສ້າງຕັ້ງຂຶ້ນຢ່າງໄວວາຈາກສ່ວນຂອງແມ່ກ່ວາຈາກ spore ໄດ້. ຕົວຢ່າງບໍາລຸງລ້ຽງ
ການປັບປຸງພັນ: ການ ນຳ ໃຊ້ຫົວຂ່າ - ລີ້ນຂອງຮ່ອມພູ, mint, wheatgrass, ແລະອື່ນໆ, ການປົ່ງຮາກອອກຕາມ
ສາຂາຕ່ໍາທີ່ສໍາຜັດກັບດິນ (ຊັ້ນ) - currants, grapes ທໍາມະຊາດ, mustache
- ສະຕໍເບີລີ້, ຫລອດໄຟ - ດອກໄມ້ tulip, daffodil, crocus. ການໃຊ້ອະໄວຍະວະ
ການຂະຫຍາຍພັນໃນເວລາທີ່ປູກພືດທີ່ປູກ: ມັນຕົ້ນແມ່ນຂະຫຍາຍພັນດ້ວຍຫົວ,
bulbs - ຜັກບົ່ວແລະຜັກທຽມ, ຂັ້ນຕອນ - currants ແລະ gooseberries, ຮາກ
offspring - cherry, plum, ການຕັດ - ຕົ້ນໄມ້ໃຫ້ຫມາກ.
4. ການສືບພັນທາງເພດ. ເນື້ອແທ້ຂອງການສືບພັນທາງເພດ
ໃນການສ້າງຕັ້ງຂອງຈຸລັງເຊື້ອ (gametes), ການປະສົມຂອງຈຸລັງເຊື້ອຊາຍ
(ເຊື້ອອະສຸຈິ) ແລະເພດຍິງ (ໄຂ່) - ການຈະເລີນພັນແລະການພັດທະນາຂອງສິ່ງ ໃໝ່
ອົງການລູກສາວຈາກໄຂ່ທີ່ມີປຸfertilຍ. ຂໍຂອບໃຈກັບການຈະເລີນພັນ
ອົງການຈັດຕັ້ງຍ່ອຍທີ່ມີຊຸດໂຄໂມໂຊມທີ່ມີຄວາມຫຼາກຫຼາຍ, ຊຶ່ງ ໝາຍ ຄວາມວ່າມີຫຼາຍ
ລັກສະນະຕ່າງໆຂອງເຊື້ອສາຍ, ເຊິ່ງເປັນຜົນມາຈາກການທີ່ມັນອາດຈະກາຍເປັນ
ປັບຕົວເຂົ້າກັບທີ່ຢູ່ອາໄສຫຼາຍຂື້ນ. ມີການແຜ່ພັນທາງເພດໃນ
ພຶຊະຄະນິດ, mosses, ຜັກກູດ, gymnosperms ແລະ angiosperms. ພາວະແຊກຊ້ອນ
ຂະບວນການທາງເພດໃນພືດໃນໄລຍະວິວັດທະນາການຂອງພວກເຂົາ, ຮູບລັກສະນະທີ່ສັບສົນທີ່ສຸດ
ຮູບແບບໃນຕົ້ນເມັດພັນ.
5. ການຂະຫຍາຍພັນດ້ວຍແກ່ນຊ່ວຍດ້ວຍແກ່ນ,
ມັນແມ່ນຄຸນລັກສະນະຂອງການອອກ ກຳ ລັງກາຍແລະຄວາມບໍ່ມັກ (angiosperms)
ການຂະຫຍາຍພັນແບບອະໄວຍະວະຍັງແຜ່ຫຼາຍ). ລໍາດັບຂອງຂັ້ນຕອນ
ການຂະຫຍາຍພັນດ້ວຍແກ່ນ: ການປະສົມເກສອນ - ການຍົກຍ້າຍຂອງເກສອນເພື່ອຄວາມເປິເປື້ອນຂອງ pistil, ຂອງມັນ
ການແຕກງອກ, ການເກີດຂື້ນໂດຍການແບ່ງປັນສອງເຊື້ອອະສຸຈິ, ຄວາມກ້າວ ໜ້າ ຂອງມັນ
ovule, ຫຼັງຈາກນັ້ນການປະສົມຂອງເຊື້ອອະສຸຈິ ໜຶ່ງ ໂຕກັບໄຂ່, ແລະໂຕອື່ນກໍ່ມີ
nucleus ມັດທະຍົມ (ໃນ angiosperms). ການສ້າງຕັ້ງຈາກເມັດ ovule -
embryo ທີ່ມີການສະຫນອງທາດອາຫານ, ແລະຈາກຝາຂອງຮວຍໄຂ່ - fetus. ແກ່ນ -
ເຊື້ອຂອງພືດຊະນິດ ໃໝ່, ໃນສະພາບທີ່ເອື້ອ ອຳ ນວຍ, ມັນງອກແລະເປັນຄັ້ງ ທຳ ອິດ
ການກ້າເບ້ຍແມ່ນໃຫ້ອາຫານໂດຍທາດອາຫານຂອງເມັດ, ແລະຈາກນັ້ນມັນກໍ່ຮາກຂອງມັນ
ເລີ່ມຕົ້ນດູດນ້ ຳ ແລະແຮ່ທາດຈາກດິນ, ແລະໃບ - ກາກບອນໄດອອກໄຊ
ອາຍແກສຈາກອາກາດໃນແສງແດດ. ຊີວິດອິດສະຫຼະຂອງຕົ້ນໄມ້ຊະນິດ ໃໝ່.
Biophysics ທາດໂປຼຕີນ
ຄຸນລັກສະນະທາງກາຍະພາບຂອງທາດໂປຼຕີນໃນຈຸລັງ, ຄຳ ນຶງເຖິງເຍື່ອນ້ ຳ ແລະການແອອັດຂອງມະຫາພາກ (eng.) ສັບສົນຫຼາຍ. ສົມມຸດຕິຖານຂອງທາດໂປຼຕີນທີ່ຖືກສັ່ງໃຫ້ເປັນ "ລະບົບຄ້າຍຄືຜລຶກ" - "ຜລຶກຜີວ ໜັງ" - ໄດ້ຮັບການສະ ໜັບ ສະ ໜູນ ຈາກການວິເຄາະການແຜ່ກະຈາຍ X-ray (ເຖິງຄວາມລະອຽດຂອງ 1 angstrom), ຄວາມ ໜາ ແໜ້ນ ຂອງການຫຸ້ມຫໍ່ສູງ, ການຮ່ວມມືຂອງຂະບວນການ denaturation ແລະຂໍ້ເທັດຈິງອື່ນໆ.
ໃນຄວາມໂປດປານຂອງສົມມຸດຕິຖານອື່ນ, ຄຸນລັກສະນະຄ້າຍຄືທາດແຫຼວຂອງທາດໂປຣຕີນໃນຂະບວນການຂອງການເຄື່ອນໄຫວແບບ intraglobular (ຮູບແບບຂອງການກະໂດດກະໂດດຫລືການແຜ່ກະຈາຍຢ່າງຕໍ່ເນື່ອງ) ແມ່ນສະແດງໃຫ້ເຫັນໂດຍການທົດລອງກ່ຽວກັບການກະແຈກກະຈາຍນິວເຄຼຍ, Mössbauer spectroscopy.

ວິທີການທົ່ວໄປ: ການສັງເຄາະ ribosomal
ທາດໂປຼຕີນຖືກສັງເຄາະໂດຍສິ່ງມີຊີວິດທີ່ມີຊີວິດຈາກອາຊິດ amino ໂດຍອີງໃສ່ຂໍ້ມູນທີ່ຖືກເຂົ້າລະຫັດໃນພັນທຸ ກຳ. ທາດໂປຼຕີນແຕ່ລະຊະນິດປະກອບດ້ວຍ ລຳ ດັບຂອງອາຊິດ amino ທີ່ເປັນເອກະລັກເຊິ່ງຖືກ ກຳ ນົດໂດຍ ລຳ ດັບ nucleotide ຂອງ gene ກຳ ລັງເຂົ້າລະບົບໂປຣຕີນ. ລະຫັດພັນທຸ ກຳ ແມ່ນວິທີການແປ ລຳ ດັບ nucleotide ຂອງ DNA (ຜ່ານ RNA) ເຂົ້າໄປໃນ ລຳ ດັບອາຊິດ amino ຂອງລະບົບຕ່ອງໂສ້ polypeptide. ລະຫັດນີ້ ກຳ ນົດການຕອບສະ ໜອງ ຂອງພາກສ່ວນ trinucleotide ຂອງ RNA, ເຊິ່ງເອີ້ນວ່າ codons, ແລະກົດອະມິໂນບາງຊະນິດທີ່ມີຢູ່ໃນໂປຣຕີນ: ລໍາດັບ AUG nucleotide, ຕົວຢ່າງ, ກົງກັບ methionine. ນັບຕັ້ງແຕ່ DNA ປະກອບດ້ວຍສີ່ປະເພດຂອງ nucleotides, ຈໍານວນທັງຫມົດຂອງ codons ທີ່ເປັນໄປໄດ້ແມ່ນ 64, ແລະເນື່ອງຈາກ 20 ອາຊິດ amino ຖືກນໍາໃຊ້ໃນທາດໂປຼຕີນ, ອາຊິດ amino ຫຼາຍແມ່ນຖືກກໍານົດໂດຍຫຼາຍກ່ວາຫນຶ່ງ codon. ສາມ codons ແມ່ນບໍ່ ສຳ ຄັນ: ພວກມັນເຮັດ ໜ້າ ທີ່ເປັນສັນຍານຢຸດ ສຳ ລັບການສັງເຄາະຂອງລະບົບຕ່ອງໂສ້ polypeptide ແລະຖືກເອີ້ນວ່າ codons ຢຸດ, ຫຼືຢຸດ codons.
ທາດໂປຼຕີນຈາກລະຫັດເຂົ້າພັນທຸ ກຳ ແມ່ນຖືກໂອນເຂົ້າໄປໃນ ລຳ ດັບ nucleotide ຂອງ messenger RNA (mRNA) ໂດຍ RNA polymerase enzymes. ໃນກໍລະນີສ່ວນໃຫຍ່ຂອງທາດໂປຼຕີນຈາກທາດໂປຼຕີນຂອງສິ່ງມີຊີວິດໄດ້ຖືກສັງເຄາະຢູ່ໃນຮໍໂມນ - ເຄື່ອງໂມເລກຸນ multicomponent ທີ່ມີຢູ່ໃນ cytoplasm ຂອງຈຸລັງ. ຂັ້ນຕອນຂອງການສັງເຄາະລະບົບຕ່ອງໂສ້ polypeptide ໂດຍ ribosome ໃນຕາຕະລາງ mRNA ຖືກເອີ້ນວ່າການແປ.
ການສັງເຄາະທາດໂປຼຕີນຈາກ Ribosomal ແມ່ນພື້ນຖານຄືກັນໃນ prokaryotes ແລະ eukaryotes, ແຕ່ແຕກຕ່າງກັນໃນບາງລາຍລະອຽດ. ດັ່ງນັ້ນ, mRNA prokaryotic ສາມາດອ່ານໂດຍ ribosomes ເຂົ້າໄປໃນລໍາດັບອາຊິດ amino ຂອງທາດໂປຼຕີນທັນທີຫຼັງຈາກການໂອນຫຼືແມ້ກະທັ້ງກ່ອນທີ່ຈະສໍາເລັດ. ໃນ eukaryotes, ບົດບັນທຶກຂໍ້ມູນເບື້ອງຕົ້ນຕ້ອງໄດ້ຜ່ານການດັດແປງຫຼາຍໆຊຸດແລະຍ້າຍເຂົ້າໄປໃນ cytoplasm (ໄປຫາສະຖານທີ່ຂອງກະດູກສັນຫຼັງ), ກ່ອນທີ່ການແປສາມາດເລີ່ມຕົ້ນໄດ້. ອັດຕາການສັງເຄາະທາດໂປຼຕີນແມ່ນສູງກວ່າໃນ prokaryotes ແລະສາມາດບັນລຸ 20 ອາຊິດ amino ຕໍ່ວິນາທີ.

ເຖິງແມ່ນວ່າກ່ອນທີ່ຈະເລີ່ມຕົ້ນການແປ, enzymes aminoacyl-tRNA synthetase ໂດຍສະເພາະແມ່ນຕິດອາຊິດ amino ໃນການຂົນສົ່ງທີ່ສອດຄ້ອງກັນ RNA (tRNA). ພາກພື້ນຂອງ tRNA, ເອີ້ນວ່າ anticodon, ສາມາດປະສົມປະສານກັນໄດ້ກັບ codon mRNA, ດັ່ງນັ້ນຈຶ່ງຮັບປະກັນການລວມເອົາສານອາຊິດ amino ທີ່ຕິດກັບ tRNA ໃນລະບົບຕ່ອງໂສ້ polypeptide ຕາມລະຫັດພັນທຸ ກຳ.
ໃນໄລຍະຂັ້ນຕົ້ນຂອງການແປ, ການລິເລີ່ມ, codon ຜູ້ລິເລີ່ມ (ໂດຍປົກກະຕິແມ່ນ methionine) ຖືກຮັບຮູ້ໂດຍສ່ວນນ້ອຍໆຂອງກະດູກສັນຫຼັງ, ເຊິ່ງທາດ methionine methionine tRNA ຕິດກັບທາດໂປຼຕີນຈາກການເລີ່ມຕົ້ນ. ພາຍຫຼັງທີ່ໄດ້ຮັບຮູ້ການເລີ່ມຕົ້ນ codon, subunit ຂະຫນາດໃຫຍ່ເຂົ້າຮ່ວມ subunit ຂະຫນາດນ້ອຍຂອງ ribosome, ແລະຂັ້ນຕອນທີສອງຂອງການແປພາສາ, elongation, ເລີ່ມຕົ້ນ. ໃນແຕ່ລະບາດກ້າວຂອງກະດູກສັນຫຼັງຕັ້ງແຕ່ 5'- ເຖິງ 3'-end ຂອງ mRNA, codon ໜຶ່ງ ໄດ້ຖືກອ່ານໂດຍການປະກອບພັນທະບັດໄຮໂດເຈນໃນລະຫວ່າງມັນແລະການຂົນສົ່ງ RNA ໃຫ້ສົມບູນຂື້ນກັບມັນ, ເຊິ່ງສ່ວນທີ່ເຫຼືອຂອງອາຊິດ amino ທີ່ສອດຄ້ອງກັນຖືກຕິດຢູ່. ການສ້າງສານພັນທະມິດ peptide ລະຫວ່າງສານອາຊິດ amino ຊະນິດສຸດທ້າຍຂອງ peptide ທີ່ ກຳ ລັງເຕີບໃຫຍ່ແລະທາດອາຊິດ amino ທີ່ຕິດກັບ tRNA ແມ່ນຖືກລະລາຍໂດຍ ribosomal RNA (rRNA), ເຊິ່ງປະກອບເປັນ peptidyl transferase center ຂອງ ribosome. ສູນກາງນີ້ຕັ້ງ ຕຳ ແໜ່ງ ປະລໍາມະນູໄນໂຕຣເຈນແລະກາກບອນຢູ່ໃນ ຕຳ ແໜ່ງ ທີ່ ເໝາະ ສົມ ສຳ ລັບການຜ່ານປະຕິກິລິຍາ. ໄລຍະທີສາມແລະສຸດທ້າຍຂອງການແປ, ການສິ້ນສຸດ, ເກີດຂື້ນໃນເວລາທີ່ ribosome ໄປຮອດ codon ຢຸດ, ຫຼັງຈາກນັ້ນປັດໃຈການຢຸດທາດໂປຼຕີນຈະເຊື່ອມຕໍ່ລະຫວ່າງ tRNA ສຸດທ້າຍແລະລະບົບຕ່ອງໂສ້ polypeptide, ຢຸດການສັງເຄາະຂອງມັນ. ໃນ ribosomes, ທາດໂປຼຕີນແມ່ນຖືກສັງເຄາະສະເຫມີຈາກ N- ກັບ C-terminus.
ການສັງເຄາະ Neribosomal
ໃນເຊື້ອລາຕ່ໍາແລະເຊື້ອແບັກທີເຣັຍບາງ, ວິທີການເພີ່ມເຕີມ (ທີ່ບໍ່ແມ່ນ ribosomal, ຫຼື multienzyme) ຂອງ biosynthesis ຂອງ peptides, ໂດຍປົກກະຕິຂອງໂຄງສ້າງຂະຫນາດນ້ອຍແລະຜິດປົກກະຕິແມ່ນເປັນທີ່ຮູ້ຈັກ.ການສັງເຄາະຂອງ peptides ເຫຼົ່ານີ້, ສ່ວນຫຼາຍແມ່ນທາດ metabolites ຂັ້ນສອງ, ແມ່ນປະຕິບັດໂດຍສະລັບສັບຊ້ອນທາດໂປຼຕີນທີ່ມີນ້ ຳ ໜັກ ໂມເລກຸນສູງ, synthesse NRS, ໂດຍບໍ່ມີການເຂົ້າຮ່ວມໂດຍກົງຂອງ ribosomes. NRS synthase ປົກກະຕິແລ້ວປະກອບດ້ວຍຫລາຍໆໂດເມນຫລືໂປຣຕີນສ່ວນຕົວທີ່ເລືອກກົດອະມິໂນ, ສ້າງເປັນ peptide bond ແລະປ່ອຍ peptide ທີ່ຖືກສັງເຄາະ. ຮ່ວມກັນ, ໂດເມນເຫຼົ່ານີ້ປະກອບມີໂມດູນ. ແຕ່ລະໂມດູນຮັບປະກັນການລວມເອົາກົດອາມີ amino ໜຶ່ງ ໃນ peptide ທີ່ຖືກສັງເຄາະ. ການສັງລວມຂອງ NRS ສາມາດປະກອບດ້ວຍໂມດູນ ໜຶ່ງ ຫລືຫຼາຍ. ບາງຄັ້ງ, ສະລັບສັບຊ້ອນເຫຼົ່ານີ້ລວມມີໂດເມນທີ່ມີຄວາມສາມາດໃນການ isomerizing ອາຊິດ L-amino (ແບບປົກກະຕິ) ເຂົ້າໄປໃນແບບຟອມ D.
ການສັງເຄາະທາງເຄມີ
ທາດໂປຼຕີນສັ້ນສາມາດໄດ້ຮັບການສັງເຄາະທາງເຄມີໂດຍໃຊ້ວິທີການສັງເຄາະອິນຊີ, ຍົກຕົວຢ່າງ, ສານເຄມີ. ສ່ວນຫຼາຍມັກ, ການສັງເຄາະສານເຄມີຂອງ peptide ເກີດຂື້ນໃນທິດທາງຕັ້ງແຕ່ C-end ຈົນເຖິງ N-end, ກົງກັນຂ້າມກັບການໃຊ້ຊີວະເຄມີກ່ຽວກັບ ribosomes. ວິທີການຂອງການສັງເຄາະສານເຄມີຜະລິດ peptides ພູມຕ້ານທານສັ້ນ (epitopes), ເຊິ່ງຈາກນັ້ນກໍ່ຖືກສັກເຂົ້າໄປໃນສັດເພື່ອໃຫ້ໄດ້ຮັບພູມຕ້ານທານສະເພາະຫຼືທາດປະສົມ. ນອກຈາກນັ້ນ, ວິທີການນີ້ຍັງຖືກ ນຳ ໃຊ້ເພື່ອຮັບເອົາຕົວຍັບຍັ້ງຂອງເອນໄຊບາງຊະນິດ. ການສັງເຄາະສານເຄມີຊ່ວຍໃຫ້ມີການແນະ ນຳ ສານອາຊິດ amino ທີ່ບໍ່ພົບໃນໂປຣຕີນ ທຳ ມະດາ, ຕົວຢ່າງ, ຜູ້ທີ່ມີປ້າຍ fluorescence ຕິດຢູ່ກັບຕ່ອງໂສ້ຂ້າງຂອງພວກມັນ. ວິທີການທາງເຄມີ ສຳ ລັບການສັງເຄາະໂປຣຕີນມີຂໍ້ ຈຳ ກັດຫຼາຍຢ່າງ: ພວກມັນບໍ່ມີປະສິດຕິພາບກັບຄວາມຍາວຂອງທາດໂປຼຕີນຫຼາຍກ່ວາ 300 ທາດໂປຼຕີນຈາກທາດໂປຼຕີນຈາກທາດໂປຼຕີນຈາກສັງເຄາະອາດຈະມີໂຄງສ້າງຂັ້ນສູນກາງທີ່ບໍ່ສະ ໝໍ່າ ສະ ເໝີ ແລະຂາດການດັດແປງຫລັງການແປທີ່ມີລັກສະນະ (ເບິ່ງຂ້າງລຸ່ມນີ້).
ການດັດແປງຫລັງການແປ

ຫຼັງຈາກການແປພາສາ ສຳ ເລັດແລ້ວ, ທາດໂປຼຕີນສ່ວນຫຼາຍແມ່ນຜ່ານການດັດແປງທາງເຄມີຕື່ມອີກເຊິ່ງເອີ້ນວ່າການດັດແປງຫລັງການແປ. ຫຼາຍກວ່າສອງຮ້ອຍຕົວແປຂອງການດັດແປງຫລັງການແປຂອງທາດໂປຼຕີນແມ່ນເປັນທີ່ຮູ້ຈັກ.
ການດັດແປງຫລັງການແປສາມາດຄວບຄຸມອາຍຸການຂອງໂປຣຕີນໃນຈຸລັງ, ກິດຈະ ກຳ ທີ່ແຂງແຮງຂອງມັນແລະການພົວພັນກັບໂປຣຕີນອື່ນໆ. ໃນບາງກໍລະນີ, ການດັດແປງຫລັງການແປແມ່ນຂັ້ນຕອນທີ່ ຈຳ ເປັນຂອງການເຕີບໂຕເຕັມຂອງທາດໂປຼຕີນ, ຖ້າບໍ່ດັ່ງນັ້ນມັນບໍ່ມີປະໂຫຍດ. ຍົກຕົວຢ່າງ, ກັບການເຕີບໂຕເຕັມຂອງອິນຊູລິນແລະບາງຮໍໂມນອື່ນໆ, ການ ຈຳ ກັດການຜະລິດຂອງຕ່ອງໂສ້ໂປລິໂອໂປຼຕິນແມ່ນ ຈຳ ເປັນ, ແລະດ້ວຍການເຕີບໃຫຍ່ຂອງທາດໂປຼຕີນຈາກເຍື່ອຫຸ້ມ plasma, glycosylation ແມ່ນ ຈຳ ເປັນ.
ການດັດແປງຫລັງການແປສາມາດມີທັງແຜ່ຫຼາຍແລະຫາຍາກ, ຂື້ນກັບສິ່ງທີ່ເປັນເອກະລັກສະເພາະ. ຕົວຢ່າງຂອງການດັດແປງແບບທົ່ວໆໄປແມ່ນການ ubiquitination (ການຍຶດເອົາລະບົບຕ່ອງໂສ້ຂອງໂມເລກຸນຫຼາຍຊະນິດຂອງທາດໂປຼຕີນ ubiquitin ສັ້ນກັບທາດໂປຼຕີນ), ເຊິ່ງເຮັດ ໜ້າ ທີ່ເປັນສັນຍານ ສຳ ລັບການ ທຳ ລາຍທາດໂປຼຕີນນີ້ໂດຍທາດໂປຣຕີນ. ການດັດແກ້ທົ່ວໄປອີກປະການຫນຶ່ງແມ່ນ glycosylation - ມັນຖືກຄາດຄະເນວ່າປະມານເຄິ່ງຫນຶ່ງຂອງທາດໂປຼຕີນຂອງມະນຸດແມ່ນ glycosylated. ການດັດແກ້ທີ່ຫາຍາກປະກອບມີ tyrosination / detirozination ແລະ polyglycylation ຂອງ tubulin.
ຫນຶ່ງແລະທາດໂປຼຕີນດຽວກັນສາມາດຜ່ານການດັດແປງຫຼາຍຢ່າງ. ດັ່ງນັ້ນ, histones (ທາດໂປຼຕີນທີ່ເປັນສ່ວນ ໜຶ່ງ ຂອງ chromatin ໃນ eukaryotes) ພາຍໃຕ້ເງື່ອນໄຂທີ່ແຕກຕ່າງກັນສາມາດຜ່ານການປ່ຽນແປງຫຼາຍກວ່າ 150 ຊະນິດ.
ການດັດແປງຫລັງການແປແມ່ນແບ່ງອອກເປັນ:
- ການດັດແປງວົງຈອນຫລັກ,
- ການເກັບກູ້ຂອງສານຕົກຄ້າງ methionine N-terminal,
- proteolysis ທີ່ ຈຳ ກັດ - ການ ກຳ ຈັດຊິ້ນສ່ວນຂອງໂປຣຕີນທີ່ສາມາດເກີດຂື້ນຈາກຈຸດສຸດທ້າຍ (ການແຍກ ລຳ ດັບຂອງສັນຍານ) ຫຼືໃນບາງກໍລະນີ, ຢູ່ເຄິ່ງ ໜຶ່ງ ຂອງໂມເລກຸນ (ການເຕີບໂຕເຕັມຂອງອິນຊູລິນ),
- ການຍຶດຕິດຂອງກຸ່ມເຄມີຕ່າງໆເພື່ອບໍ່ໃຫ້ກຸ່ມ amino ແລະ carboxyl ຟຣີ (N-acylation, myristoylation, ແລະອື່ນໆ),
- ການດັດແປງຕ່ອງໂສ້ຂ້າງຂອງອາຊິດ amino,
- ການເພີ່ມຫຼືການລ້າງກຸ່ມທາດເຄມີຂະ ໜາດ ນ້ອຍ (glycosylation, phosphorylation, ແລະອື່ນໆ),
- ການເພີ່ມເຕີມຂອງ lipids ແລະ hydrocarbons,
- ການປ່ຽນແປງຂອງການຕົກຄ້າງອາຊິດ amino ທີ່ບໍ່ໄດ້ມາດຕະຖານ (ການສ້າງຕັ້ງຂອງ citrulline),
- ການສ້າງຕັ້ງຂອງຂົວ disulfide ລະຫວ່າງທາດ cysteine,
- ການເພີ່ມທາດໂປຼຕີນນ້ອຍໆ (sumoylation ແລະ ubiquitination).
ການຂົນສົ່ງພາຍໃນແລະການຈັດລຽງ ລຳ ດັບ
ທາດໂປຼຕີນທີ່ຖືກສັງເຄາະຢູ່ໃນ cytoplasm ຂອງຈຸລັງ eukaryotic ຕ້ອງໄດ້ຖືກຂົນສົ່ງໄປສູ່ອະໄວຍະວະຕ່າງໆຂອງຈຸລັງທີ່ແຕກຕ່າງກັນ: ແກນ, mitochondria, endoplasmic reticulum (EPR), ອຸປະກອນ Golgi, lysosomes, ແລະອື່ນໆ, ແລະທາດໂປຼຕີນບາງຢ່າງຕ້ອງເຂົ້າໄປໃນກາງຂະຫນາດກາງ. ເພື່ອຈະເຂົ້າໄປໃນພາກສ່ວນໃດ ໜຶ່ງ ຂອງຈຸລັງ, ໂປຕີນຕ້ອງມີປ້າຍສະເພາະ. ໃນກໍລະນີຫຼາຍທີ່ສຸດ, ປ້າຍດັ່ງກ່າວແມ່ນສ່ວນ ໜຶ່ງ ຂອງ ລຳ ດັບທາດອາຊິດ amino ຂອງທາດໂປຼຕີນເອງ (peptide ຜູ້ ນຳ, ຫຼືສັນຍານຕາມ ລຳ ດັບຂອງທາດໂປຼຕີນ), ແຕ່ໃນບາງກໍລະນີ, oligosaccharides ທີ່ຕິດກັບທາດໂປຼຕີນແມ່ນປ້າຍ.
ການຂົນສົ່ງທາດໂປຼຕີນໃນ EPR ແມ່ນປະຕິບັດຍ້ອນວ່າມັນຖືກສັງເຄາະ, ເນື່ອງຈາກວ່າ ribosomes ສັງເຄາະທາດໂປຼຕີນທີ່ມີສັນຍານສັນຍານ ສຳ ລັບ EPR“ ນັ່ງ” ກ່ຽວກັບໂປຣຕີນພິເສດຢູ່ໃນຊັ້ນນອກຂອງມັນ. ຈາກ EPR ເຖິງອຸປະກອນ Golgi, ແລະຈາກນັ້ນໄປຫາ lysosomes ແລະເຍື່ອພາຍນອກຫຼືຂະ ໜາດ ກາງ, ທາດໂປຼຕີນເຂົ້າຜ່ານການຂົນສົ່ງ vesicular. ທາດໂປຼຕີນທີ່ມີສັນຍານທ້ອງຖິ່ນນິວເຄຼຍເຂົ້າສູ່ແກນຜ່ານຮູດັງນິວເຄຼຍ. ໃນ mitochondria ແລະ chloroplasts, ທາດໂປຼຕີນທີ່ມີລໍາດັບສັນຍານທີ່ສອດຄ້ອງກັນເຂົ້າໄປໃນຮູຂຸມຂົນຜູ້ແປທາດໂປຼຕີນໂດຍສະເພາະໂດຍການມີສ່ວນຮ່ວມຂອງ chaperones.
ຮັກສາໂຄງສ້າງແລະການເຊື່ອມໂຊມ
ການຮັກສາໂຄງສ້າງທາງກວ້າງຂອງພື້ນທີ່ຂອງໂປຣຕີນແມ່ນ ສຳ ຄັນ ສຳ ລັບການເຮັດວຽກປົກກະຕິຂອງມັນ. ການພັບທາດໂປຼຕີນທີ່ບໍ່ຖືກຕ້ອງທີ່ ນຳ ໄປສູ່ການລວມຕົວຂອງພວກມັນສາມາດເກີດຈາກການກາຍພັນ, ການຜຸພັງ, ສະພາບຄວາມກົດດັນ, ຫຼືການປ່ຽນແປງທົ່ວໂລກທາງດ້ານຮ່າງກາຍຂອງຈຸລັງ. ການຮວບຮວມທາດໂປຼຕີນແມ່ນສັນຍານລັກສະນະຂອງຜູ້ສູງອາຍຸ. ມັນໄດ້ຖືກເຊື່ອວ່າການພັບທາດໂປຼຕີນທີ່ບໍ່ຖືກຕ້ອງແມ່ນສາເຫດຫຼືເຮັດໃຫ້ພະຍາດທີ່ຮ້າຍແຮງເຊັ່ນພະຍາດ fibrosis cystic, ໂຣກສະສົມ lysosomal. ເຊັ່ນດຽວກັນກັບຄວາມຜິດປົກກະຕິກ່ຽວກັບໂຣກ neurodegenerative (ໂຣກ Alzheimer, Huntington ແລະ Parkinson).
ໃນຂະບວນການວິວັດທະນາການຂອງຈຸລັງ, ມີ 4 ກົນໄກຫລັກໄດ້ຖືກພັດທະນາເພື່ອຕ້ານການລວບລວມທາດໂປຼຕີນ. ສອງຄັ້ງ ທຳ ອິດ - ການພັບຊ້ ຳ ຄືນ (ຂື້ນ ໃໝ່) ໂດຍການຊ່ວຍເຫຼືອຂອງ chaperones ແລະການເຮັດຄວາມສະອາດດ້ວຍທາດໂປຼຕີນ - ແມ່ນພົບເຫັນທັງເຊື້ອແບັກທີເຣັຍແລະໃນອົງການຈັດຕັ້ງທີ່ສູງກວ່າ. Autophagy ແລະການສະສົມຂອງທາດໂປຼຕີນທີ່ພັບບໍ່ຖືກຕ້ອງໃນສານອະໄວຍະວະທີ່ບໍ່ແມ່ນເຍື່ອພິເສດແມ່ນລັກສະນະຂອງ eukaryotes.

ຄວາມສາມາດຂອງທາດໂປຼຕີນໃນການຟື້ນຟູໂຄງສ້າງສາມມິຕິທີ່ຖືກຕ້ອງຫຼັງຈາກການປະນິປະນອມໄດ້ອະນຸຍາດໃຫ້ພວກເຮົາສົມມຸດຕິຖານວ່າຂໍ້ມູນທັງ ໝົດ ກ່ຽວກັບໂຄງສ້າງສຸດທ້າຍຂອງທາດໂປຼຕີນແມ່ນບັນຈຸຢູ່ໃນ ລຳ ດັບອາຊິດ amino ຂອງມັນ. ໃນປະຈຸບັນ, ທິດສະດີທີ່ວ່າຄວາມສອດຄ່ອງທີ່ ໝັ້ນ ຄົງຂອງທາດໂປຼຕີນມີພະລັງງານທີ່ບໍ່ເສຍຄ່າ ໜ້ອຍ ທີ່ສຸດເມື່ອທຽບກັບຄວາມເປັນໄປໄດ້ອື່ນໆຂອງ polypeptide ນີ້.
ໃນຈຸລັງມີກຸ່ມໂປຣຕີນເຊິ່ງ ໜ້າ ທີ່ຂອງມັນແມ່ນເພື່ອຮັບປະກັນການພັບທາດໂປຼຕີນອື່ນໆທີ່ຖືກຕ້ອງຫຼັງຈາກການສັງເຄາະຂອງມັນໃສ່ກະດູກສັນຫຼັງ, ເພື່ອຟື້ນຟູໂຄງສ້າງຂອງໂປຣຕີນພາຍຫຼັງຄວາມເສຍຫາຍຂອງມັນ, ພ້ອມທັງການສ້າງແລະການແບ່ງປັນສະລັບສັບຊ້ອນຂອງໂປຣຕີນ. ທາດໂປຼຕີນເຫຼົ່ານີ້ຖືກເອີ້ນວ່າ chaperones. ຄວາມເຂັ້ມຂຸ້ນຂອງ chaperones ຫຼາຍໃນຫ້ອງເພີ່ມຂື້ນດ້ວຍອຸນຫະພູມອາກາດລ້ອມຮອບທີ່ເພີ່ມຂື້ນ, ສະນັ້ນພວກມັນແມ່ນຂຶ້ນກັບກຸ່ມ Hsp (ໂປຣຕີນຄວາມຮ້ອນຂອງອັງກິດ - ໂປຣຕີນຊshockອກຄວາມຮ້ອນ). ຄວາມ ສຳ ຄັນຂອງການເຮັດວຽກປົກກະຕິຂອງ chaperones ສຳ ລັບການເຮັດວຽກຂອງຮ່າງກາຍສາມາດຖືກສະແດງໂດຍຕົວຢ່າງຂອງ cry-crystallin chaperone ເຊິ່ງເປັນສ່ວນ ໜຶ່ງ ຂອງເລນຂອງສາຍຕາຂອງມະນຸດ. ການກາຍພັນໃນທາດໂປຼຕີນນີ້ເຮັດໃຫ້ເກີດທັດສະນະຂອງເລນອັນເນື່ອງມາຈາກການລວມຕົວຂອງໂປຣຕີນແລະເປັນຜົນໃຫ້ເກີດອາການຕາຕໍ້.
ຖ້າໂຄງສ້າງທາດໂປຼຕີນຂັ້ນສາມບໍ່ສາມາດຟື້ນຟູໄດ້, ມັນຈະຖືກ ທຳ ລາຍໂດຍຈຸລັງ. Enzymes ທີ່ເຮັດໃຫ້ໂປຣຕີນເສື່ອມສະລາຍຖືກເອີ້ນວ່າທາດໂປຣຕີນ.ໃນສະຖານທີ່ຂອງການໂຈມຕີຂອງໂມເລກຸນອະນຸພາກ, ທາດ enzymes proteolytic ແບ່ງອອກເປັນ endopeptidases ແລະ exopeptidases:
- Endopeptidases, ຫຼືທາດໂປຼຕີນຈາກທາດໂປຼຕີນ, ຍຶດພັນ peptide ພັນທະບັດພາຍໃນຕ່ອງໂສ້ peptide. ພວກເຂົາຮັບຮູ້ແລະຜູກສາຍ peptide ສັ້ນໆຂອງຊັ້ນໃຕ້ດິນແລະໂດຍສະເພາະພັນທະບັດລະຫວ່າງທາດອາຊິດ amino ທີ່ແນ່ນອນ.
- Exopeptidases hydrolyze peptides ຈາກປາຍຂອງລະບົບຕ່ອງໂສ້: aminopeptidases ຈາກ N-terminus, carboxypeptidases ຈາກ C-terminus. ສຸດທ້າຍ, ຢາ dipeptidases ລ້າງພຽງແຕ່ຢາ dipeptides ເທົ່ານັ້ນ.
ອີງຕາມກົນໄກການວັດແທກ, ສະຫະພັນສາກົນດ້ານຊີວະວິທະຍາແລະຊີວະວິທະຍາໂມເລກຸນ ກຳ ນົດທາດໂປຼຕີນຕ່າງໆຫຼາຍຊັ້ນ, ໃນນັ້ນມີທາດໂປຼຕີນຈາກເຊນ, ທາດໂປຼຕີນ aspartic, ທາດໂປຼຕິນ cysteine, ແລະໂລຫະໂລຫະ.
ປະເພດພິເສດຂອງ protease ແມ່ນ proteasome, ທາດໂປຼຕີນທີ່ມີທາດ multisubunit ຂະ ໜາດ ໃຫຍ່ທີ່ມີຢູ່ໃນແກນແລະ cytoplasm ຂອງ eukaryotes, ໂບຮານຄະດີແລະເຊື້ອແບັກທີເຣັຍບາງຊະນິດ.
ເພື່ອໃຫ້ທາດໂປຼຕີນຈາກເປົ້າ ໝາຍ ໄດ້ຮັບການຍັບຍັ້ງຈາກໂປຣຕີນ, ມັນຕ້ອງຖືກຕິດສະຫລາກໂດຍຕິດກັບໂປຣຕີນ ubiquitin ຂະ ໜາດ ນ້ອຍ. ປະຕິກິລິຍາເພີ່ມຂອງ ubiquitin ແມ່ນຖືກກະຕຸ້ນໂດຍສາຍຕາຂອງ enzymes ubiquitin. ການເພີ່ມໂມເລກຸນ ubiquitin ທຳ ອິດໃຫ້ກັບໂປຣຕີນເຮັດເປັນສັນຍານ ສຳ ລັບເສັ້ນເອັນ ສຳ ລັບການເພີ່ມໂມເລກຸນ ubiquitin ຕື່ມອີກ. ດັ່ງນັ້ນ, ລະບົບຕ່ອງໂສ້ຂອງ polyubiquitin ແມ່ນຕິດກັບທາດໂປຼຕີນ, ເຊິ່ງຜູກກັບທາດໂປຣຕີນແລະຮັບປະກັນການກັກຂອງໂປຕີນເປົ້າ ໝາຍ. ໂດຍທົ່ວໄປ, ລະບົບນີ້ເອີ້ນວ່າການເຊື່ອມໂຊມຂອງທາດໂປຼຕີນຈາກ ubiquitin. ການເຊື່ອມໂຊມຂອງ 80-90% ຂອງໂປຣຕີນພາຍໃນປະກົດການເກີດຂື້ນດ້ວຍການມີສ່ວນຮ່ວມຂອງໂປຣຕີນ.
ການເຊື່ອມໂຊມຂອງທາດໂປຼຕີນໃນ peroxisomes ແມ່ນມີຄວາມ ສຳ ຄັນຕໍ່ຂະບວນການຂອງຈຸລັງຫຼາຍຢ່າງ, ລວມທັງວົງຈອນຂອງຈຸລັງ, ລະບຽບການສະແດງອອກຂອງເຊື້ອ, ແລະການຕອບສະ ໜອງ ຕໍ່ຄວາມກົດດັນຂອງການຜຸພັງ.

Autophagy ແມ່ນຂະບວນການຂອງການເຊື່ອມໂຊມຂອງຊີວະມວນຊີວະພາບທີ່ມີຊີວິດຢູ່ດົນນານ, ໂດຍສະເພາະທາດໂປຼຕີນ, ເຊັ່ນດຽວກັນກັບອະໄວຍະວະໃນ lysosomes (ໃນສັດລ້ຽງລູກດ້ວຍນົມ) ຫຼື vacuoles (ໃນເຊື້ອລາ). Autophagy ມາພ້ອມກັບກິດຈະ ກຳ ທີ່ ສຳ ຄັນຂອງຈຸລັງປົກກະຕິແຕ່ຂາດສານອາຫານ, ການມີສານຜິດໃນອະໄວຍະວະທີ່ຢູ່ໃນ cytoplasm ແລະໃນທີ່ສຸດ, ການມີທາດໂປຼຕິນທີ່ບໍ່ໄດ້ປະໂຫຍດສ່ວນ ໜຶ່ງ ແລະການລວມຕົວຂອງພວກມັນໃນ cytoplasm ສາມາດເຮັດ ໜ້າ ທີ່ເປັນໂຕກະຕຸ້ນໃນການເພີ່ມຂະບວນການຂອງ autophagy ໃນຈຸລັງ.
ສາມຊະນິດຂອງ autophagy ໄດ້ຖືກ ຈຳ ແນກໄດ້ແກ່: microautophagy, macroautophagy, ແລະ chaperone-dependent autophagy.
ໃນລະຫວ່າງຈຸລິນຊີໄມໂຄຣໂມເລກຸນແລະຊິ້ນສ່ວນຂອງຈຸລັງຈຸລັງຖືກຈັບໂດຍ lysosome. ດ້ວຍວິທີນີ້, ຈຸລັງສາມາດຍ່ອຍໂປຣຕີນດ້ວຍການຂາດພະລັງງານຫລືວັດສະດຸກໍ່ສ້າງ (ຕົວຢ່າງ, ໃນເວລາທີ່ມີຄວາມອຶດຫິວ). ແຕ່ຂະບວນການຂອງຈຸລິນຊີເກີດຂື້ນພາຍໃຕ້ສະພາບປົກກະຕິແລະໂດຍທົ່ວໄປແມ່ນບໍ່ ຈຳ ແນກ. ບາງຄັ້ງສານ organoids ກໍ່ຖືກຍ່ອຍສະຫຼາຍໃນໄລຍະ microautophagy, ຕົວຢ່າງ, microautophagy ຂອງ peroxisomes ແລະ microautophagy ບາງສ່ວນຂອງ nuclei ເຊິ່ງຈຸລັງຍັງຄົງສາມາດໃຊ້ໄດ້ຖືກອະທິບາຍໄວ້ໃນເຊື້ອລາ.
ໃນມະຫາພາກ, ສ່ວນ ໜຶ່ງ ຂອງ cytoplasm (ມັກຈະມີສ່ວນປະກອບຂອງອະໄວຍະວະຕ່າງໆ) ຖືກອ້ອມຮອບດ້ວຍສ່ວນປະກອບຂອງເຍື່ອຄ້າຍຄືກັບຖັງຂອງ reticulum endoplasmic. ດ້ວຍເຫດນັ້ນ, ເວັບໄຊທ໌ນີ້ແຍກອອກຈາກສ່ວນທີ່ເຫຼືອຂອງ cytoplasm ໂດຍສອງເຍື່ອ. organelles ທີ່ມີຝາອັດລົມສອງຊັ້ນດັ່ງກ່າວເອີ້ນວ່າ autophagosomes. Autophagosomes ປະສົມປະສານກັບ lysosomes, ປະກອບເປັນ autophagolysosomes, ໃນນັ້ນ organelles ແລະສ່ວນທີ່ເຫຼືອຂອງເນື້ອໃນຂອງ autophagosomes ຖືກຍ່ອຍ. ປາກົດຂື້ນ, macroautophagy ແມ່ນຍັງບໍ່ເລືອກ, ເຖິງແມ່ນວ່າມັນມັກຈະເນັ້ນຫນັກວ່າດ້ວຍການຊ່ວຍເຫຼືອຂອງມັນຫ້ອງສາມາດກໍາຈັດສານຜິດປົກກະຕິທີ່ມີ "ທີ່ລ້າສະໄຫມ" (mitochondria, ribosomes, ແລະອື່ນໆ).
ປະເພດທີສາມຂອງ autophagy ແມ່ນ chaperone-dependant. ໃນວິທີການນີ້, ການຂົນສົ່ງໂດຍກົງຂອງທາດໂປຼຕີນທີ່ຖືກປະຕິເສດບາງສ່ວນຈາກ cytoplasm ຜ່ານເຍື່ອ lysosome ໄປສູ່ຢູ່ຕາມໂກນຂອງມັນເກີດຂື້ນ, ບ່ອນທີ່ພວກມັນຖືກຍ່ອຍ. ປະເພດຂອງ autophagy ຊະນິດນີ້, ທີ່ຖືກອະທິບາຍພຽງແຕ່ໃນສັດລ້ຽງລູກດ້ວຍນົມ, ແມ່ນການກະຕຸ້ນຈາກຄວາມກົດດັນ.

JUNQ ແລະ IPOD
ພາຍໃຕ້ຄວາມກົດດັນ, ເມື່ອຈຸລັງ eukaryotic ບໍ່ສາມາດຮັບມືກັບການສະສົມຂອງທາດໂປຣຕີນທີ່ບໍ່ຖືກຕ້ອງ ຈຳ ນວນຫຼວງຫຼາຍ, ພວກມັນສາມາດຖືກສົ່ງໄປຫາ ໜຶ່ງ ໃນສອງປະເພດຂອງອະໄວຍະວະຊົ່ວຄາວ - JUNQ ແລະ IPOD (ພາສາອັງກິດ) ລັດເຊຍ. .
JUNQ (Eng. JUxta ຫ້ອງຄວບຄຸມຄຸນນະພາບນິວເຄຼຍ) ມີສ່ວນພົວພັນກັບດ້ານນອກຂອງເຍື່ອນິວເຄຼຍແລະມີທາດໂປຣຕີນທີ່ສາມາດໂອນເຂົ້າ cytoplasm ໄດ້ຢ່າງໄວວາ, ເຊັ່ນດຽວກັນກັບ chaperones ແລະ proteasomes. ໜ້າ ທີ່ທີ່ມີຈຸດປະສົງຂອງ JUNQ ແມ່ນການ ບຳ ລຸງແລະ / ຫຼືການ ທຳ ລາຍໂປຣຕີນ.
ເງິນຝາກທາດໂປຼຕີນຈາກທາດໂປຼຕີນຈາກທາດໂປຼຕີນຈາກທາດໂປຼຕີນຈາກທາດໂປຼຕີນຈາກທາດໂປຼຕີນຈາກທາດແຫຼວລະລາຍ (IPOD) ແມ່ນຕັ້ງຢູ່ໃກ້ກັບສູນກາງທາດໂປຼຕີນທີ່ບໍ່ມີທາດໂປຼຕີນ. ການສະສົມທາດໂປຼຕີນເຫລົ່ານີ້ໃນ IPOD ສາມາດປ້ອງກັນການພົວພັນຂອງພວກມັນກັບໂຄງສ້າງຂອງຈຸລັງປົກກະຕິ, ສະນັ້ນ, ມັນເຊື່ອວ່າການລວມຕົວນີ້ມີ ໜ້າ ທີ່ປ້ອງກັນ.
ໜ້າ ທີ່ຂອງໂປຣຕີນໃນຮ່າງກາຍ
ເຊັ່ນດຽວກັນກັບ macromolecules ຊີວະພາບອື່ນໆ (polysaccharides, lipids ແລະກົດ nucleic), ທາດໂປຼຕີນແມ່ນສ່ວນປະກອບທີ່ ສຳ ຄັນຂອງສິ່ງມີຊີວິດທັງ ໝົດ ແລະມີບົດບາດ ສຳ ຄັນໃນຊີວິດຂອງຈຸລັງ. ທາດໂປຼຕີນປະຕິບັດຂະບວນການ E -book. ພວກມັນເປັນສ່ວນ ໜຶ່ງ ຂອງໂຄງສ້າງພາຍໃນກະເພາະອາຫານ - ອະໄວຍະວະແລະ cytoskeleton, ເຊິ່ງຖືກປິດລັບໃນຊ່ອງທາງນອກ, ບ່ອນທີ່ພວກມັນສາມາດເຮັດ ໜ້າ ທີ່ເປັນສັນຍານທີ່ສົ່ງຕໍ່ລະຫວ່າງຈຸລັງ, ເຂົ້າຮ່ວມໃນການສ້າງທາດອາຫານແລະການສ້າງສານ intercellular.
ການຈັດປະເພດທາດໂປຼຕີນຕາມ ໜ້າ ທີ່ຂອງພວກມັນແມ່ນມີລັກສະນະຕັດສິນຫລາຍ, ເພາະວ່າທາດໂປຼຕີນດຽວກັນສາມາດເຮັດ ໜ້າ ທີ່ຫຼາຍຢ່າງ. ຕົວຢ່າງທີ່ສຶກສາໄດ້ດີຂອງການເຮັດວຽກຫຼາຍແບບດັ່ງກ່າວແມ່ນ lysyl tRNA synthetase, ເຊິ່ງເປັນເອນໄຊຈາກຊັ້ນຮຽນຂອງ synthetases aminoacyl tRNA, ເຊິ່ງບໍ່ພຽງແຕ່ເອົາສານຕົກຄ້າງຂອງ lysine ເຂົ້າກັບ tRNA, ແຕ່ຍັງຄວບຄຸມການໂອນຍ້າຍຂອງພັນທຸ ກຳ ນຳ ອີກ. ທາດໂປຼຕີນປະຕິບັດຫນ້າທີ່ຫຼາຍຢ່າງຍ້ອນກິດຈະກໍາ enzymatic ຂອງພວກເຂົາ. ສະນັ້ນ, ເອນໄຊແມ່ນໂປຣຕີນ myosin, ໂປຣຕີນ kinase ທີ່ມີກົດລະບຽບ, ສົ່ງທາດໂປຼຕີນຈາກ sodium-potassium adenosine triphosphatase, ແລະອື່ນໆ.

ການເຮັດວຽກຂອງສານເຄມີ
ໜ້າ ທີ່ທີ່ຮູ້ກັນດີທີ່ສຸດຂອງທາດໂປຼຕີນໃນຮ່າງກາຍແມ່ນການກະຕຸ້ນປະຕິກິລິຍາທາງເຄມີຕ່າງໆ. Enzymes ແມ່ນໂປຣຕີນທີ່ມີຄຸນສົມບັດສະເພາະຂອງທາດໂປຼຕິນ, ນັ້ນກໍ່ຄື enzyme ແຕ່ລະຊະນິດກໍ່ມີປະຕິກິລິຍາຄ້າຍຄືກັນ ໜຶ່ງ ຫຼືຫຼາຍຊະນິດ. Enzymes ກະຕຸ້ນການແບ່ງແຍກຂອງໂມເລກຸນ (catabolism) ແລະການສັງເຄາະ (anabolism) ລວມທັງການ ຈຳ ລອງ DNA ແລະການສ້ອມແປງແລະການສັງເຄາະ RNA ຂອງມາຕຣິກເບື້ອງ. ໃນປີ 2013, ມີລາຍລະອຽດຫຼາຍກ່ວາ 5,000 ເອນໄຊ. ຍົກຕົວຢ່າງການເລັ່ງຂອງປະຕິກິລິຍາທີ່ເປັນຜົນມາຈາກການວິເຄາະ enzymatic ສາມາດເປັນສິ່ງທີ່ໃຫຍ່ຫຼວງ: ປະຕິກິລິຍາທີ່ຖືກລະບາຍໂດຍ enzyme orotidine-5'-phosphate decarboxylase, ຍົກຕົວຢ່າງ, ເພີ່ມຂື້ນ 10 17 ເທົ່າໄວກ່ວາທາດທີ່ບໍ່ມີທາດ (ປະລິມານເຄິ່ງຊີວິດຂອງການຖອດລະລາຍຂອງອາຊິດ orotic ແມ່ນ 78 ລ້ານປີໂດຍບໍ່ມີທາດ enzyme ແລະ 18 millise). ໂມເລກຸນທີ່ຕິດກັບເອນໄຊແລະການປ່ຽນແປງທີ່ເປັນຜົນມາຈາກການປະຕິກິລິຍາເອີ້ນວ່າຊັ້ນຍ່ອຍ.
ເຖິງແມ່ນວ່າ enzymes ປົກກະຕິແລ້ວປະກອບມີຫຼາຍຮ້ອຍສ່ວນຂອງການຕົກຄ້າງຂອງອາຊິດ amino, ມີພຽງແຕ່ສ່ວນນ້ອຍໆຂອງມັນທີ່ພົວພັນກັບອະນຸພາກ, ແລະເຖິງແມ່ນວ່າປະລິມານທີ່ນ້ອຍກວ່າ - ໂດຍສະເລ່ຍປະມານອາຊິດ amino amino ປະມານ 3-4, ເຊິ່ງມັກຕັ້ງຢູ່ໄກຈາກກັນແລະກັນໃນໂຄງສ້າງປະຖົມ - ມີສ່ວນພົວພັນໂດຍກົງໃນ catalysis. ສ່ວນ ໜຶ່ງ ຂອງໂມເລກຸນເອນໄຊທີ່ສະ ໜອງ ການຜູກມັດຍ່ອຍແລະການຍ່ອຍສະຫຼາຍໄດ້ຖືກເອີ້ນວ່າສູນກາງເຄື່ອນໄຫວ.
ໃນປີ 1992, ສະຫະພັນສາກົນວິຊາຊີວະເຄມີແລະຊີວະສາດໂມເລກຸນໄດ້ສະ ເໜີ ສະບັບສຸດທ້າຍຂອງນາມສະກຸນທາດຊັ້ນໂດຍອີງໃສ່ປະເພດຕິກິລິຍາທີ່ຖືກກະຕຸ້ນໂດຍພວກມັນ. ອີງຕາມຊື່ນາມສະກຸນນີ້, ຊື່ຂອງ enzymes ຕ້ອງມີສະ ເໝີ ຕົ້ນສະ ເໝີ ປາຍ -ພື້ນຖານ ແລະສ້າງຕັ້ງຂື້ນຈາກຊື່ຂອງປະຕິກິລິຍາທີ່ລະບາຍແລະທາດຍ່ອຍຂອງມັນ. enzyme ແຕ່ລະຄົນແມ່ນຖືກມອບ ໝາຍ ໃຫ້ເປັນລະຫັດສ່ວນບຸກຄົນເຊິ່ງມັນງ່າຍຕໍ່ການ ກຳ ນົດ ຕຳ ແໜ່ງ ຂອງມັນໃນ ລຳ ດັບຊັ້ນຂອງ enzymes.ອີງຕາມປະເພດຂອງປະຕິກິລິຍາຂອງສານເຄມີ, enzymes ທັງ ໝົດ ແບ່ງອອກເປັນ 6 ຊັ້ນ:
- CF 1: oxidoreductases ທີ່ເຮັດໃຫ້ເກີດປະຕິກິລິຍາໂຕ້ຕອບແບບຜິດປົກກະຕິ,
- CF 2: ການໂອນຍ້າຍທີ່ເຮັດໃຫ້ການເຄື່ອນຍ້າຍຂອງກຸ່ມເຄມີຈາກໂມເລກຸນຍ່ອຍ ໜຶ່ງ ຫາອີກກຸ່ມ ໜຶ່ງ,
- CF 3: Hydrolases ເຮັດໃຫ້ເກີດຄວາມກົດດັນຂອງລະບົບພັນທະບັດເຄມີ,
- CF 4: Lyases ເຮັດໃຫ້ເກີດການລະເມີດຂອງພັນທະບັດເຄມີໂດຍບໍ່ມີການດູດຊຶມດ້ວຍການສ້າງພັນທະບັດສອງໃນຜະລິດຕະພັນ ໜຶ່ງ,
- CF 5: Isomerases ທີ່ກະຕຸ້ນການປ່ຽນແປງທາງດ້ານໂຄງສ້າງຫຼືເລຂາຄະນິດໃນໂມເລກຸນຍ່ອຍ,
- CF 6: ລີ້ນທີ່ຊ່ວຍກະຕຸ້ນການສ້າງພັນທະບັດທາງເຄມີລະຫວ່າງຊັ້ນໃຕ້ດິນເນື່ອງຈາກການດູດຊືມຂອງ ATP diphosphate bond ຫຼື triphosphate ຄ້າຍຄືກັນ.
ໜ້າ ທີ່ໂຄງສ້າງ
ທາດໂປຼຕີນໃນໂຄງສ້າງຂອງ cytoskeleton, ເປັນປະເພດແຂນ, ໃຫ້ຮູບຮ່າງຂອງຈຸລັງແລະອະໄວຍະວະຕ່າງໆແລະມີສ່ວນຮ່ວມໃນການປ່ຽນຮູບຮ່າງຂອງຈຸລັງ. ທາດໂປຼຕີນໃນໂຄງສ້າງສ່ວນໃຫຍ່ແມ່ນມີເນື້ອເຍື່ອ: ຕົວຢ່າງເຊັ່ນ actin ແລະ tubulin monomers ແມ່ນຕົວຢ່າງເຊັ່ນໂປຕີນທົ່ວໆໄປ, ທາດໂປຼຕີນທີ່ລະລາຍໄດ້, ແຕ່ວ່າຫຼັງຈາກທາດໂປຼຕີນໂພລີເມັນແລ້ວພວກມັນກໍ່ສ້າງເປັນສາຍຍາວທີ່ປະກອບເປັນ cytoskeleton, ເຊິ່ງຊ່ວຍໃຫ້ເຊນຮັກສາຮູບຮ່າງ. Collagen ແລະ elastin ແມ່ນສ່ວນປະກອບຫຼັກຂອງສານ intercellular ຂອງເນື້ອເຍື່ອເຊື່ອມຕໍ່ (ຕົວຢ່າງ, ແຜ່ນກະດູກ), ແລະຜົມ, ເລັບ, ຂົນສັດແລະຫອຍບາງປະກອບດ້ວຍທາດໂປຼຕີນໂຄງສ້າງ keratin ອື່ນ.

ໜ້າ ທີ່ປ້ອງກັນ
ມີຫຼາຍປະເພດຂອງ ໜ້າ ທີ່ປ້ອງກັນຂອງໂປຣຕີນ:
- ການປ້ອງກັນຮ່າງກາຍ. ການປ້ອງກັນຮ່າງກາຍຂອງຮ່າງກາຍແມ່ນສະ ໜອງ ໂດຍ collagen, ທາດໂປຼຕີນທີ່ສ້າງເປັນພື້ນຖານຂອງສານ intercellular ຂອງເນື້ອເຍື່ອເຊື່ອມຕໍ່ (ລວມທັງກະດູກ, ເນື້ອເຍື່ອ, tendons ແລະຊັ້ນເລິກຂອງຜິວ ໜັງ (dermis)), keratin ເຊິ່ງປະກອບເປັນພື້ນຖານຂອງໄສ້ horny, ຂົນ, ຂົນສັດ, horns ແລະອະນຸພັນອື່ນໆຂອງໂລກລະບາດ. ໂດຍປົກກະຕິ, ທາດໂປຼຕີນດັ່ງກ່າວຖືກຖືວ່າເປັນໂປຣຕີນທີ່ມີ ໜ້າ ທີ່ໂຄງສ້າງ. ຕົວຢ່າງຂອງໂປຣຕີນຂອງກຸ່ມນີ້ແມ່ນໂຣກ fibrinogen ແລະ thrombin ທີ່ກ່ຽວຂ້ອງກັບການກ້າມເລືອດ.
- ການປ້ອງກັນສານເຄມີ. ຄວາມຜູກພັນຂອງສານພິດກັບໂມເລກຸນທາດໂປຼຕີນສາມາດສະ ໜອງ ສານພິດຂອງພວກມັນ. ບົດບາດທີ່ ສຳ ຄັນໂດຍສະເພາະໃນການ ກຳ ຈັດສານພິດໃນມະນຸດແມ່ນມີບົດບາດໂດຍເອນໄຊຕັບທີ່ ທຳ ລາຍສານພິດຫຼືປ່ຽນມັນເຂົ້າໄປໃນຮູບແບບທີ່ລະລາຍ, ເຊິ່ງປະກອບສ່ວນເຂົ້າໃນການລົບລ້າງຢ່າງໄວວາຈາກຮ່າງກາຍ.
- ພູມຕ້ານທານ. ທາດໂປຼຕີນທີ່ເຮັດໃຫ້ເລືອດແລະທາດແຫຼວໃນຮ່າງກາຍມີສ່ວນຮ່ວມໃນການຕອບໂຕ້ປ້ອງກັນຂອງຮ່າງກາຍຕໍ່ທັງຄວາມເສຍຫາຍແລະການໂຈມຕີຂອງເຊື້ອພະຍາດ. ທາດໂປຼຕີນຂອງລະບົບປະສົມແລະພູມຕ້ານທານ (immunoglobulins) ແມ່ນຂຶ້ນກັບທາດໂປຼຕີນຂອງກຸ່ມທີສອງ, ພວກມັນເຮັດໃຫ້ເຊື້ອແບັກທີເຣັຍ, ໄວຣັສຫຼືທາດໂປຼຕີນຈາກຕ່າງປະເທດຫຼຸດລົງ. ຢາຕ້ານເຊື້ອທີ່ເປັນສ່ວນ ໜຶ່ງ ຂອງລະບົບພູມຕ້ານທານທີ່ສາມາດປັບຕົວໄດ້, ຕິດກັບສານທີ່ເປັນຕ່າງປະເທດເຂົ້າໄປໃນຮ່າງກາຍ, ຕ້ານອະນຸມູນອິດສະຫລະ, ແລະເຮັດໃຫ້ມັນເປັນກາງ, ເຮັດໃຫ້ພວກມັນຢູ່ໃນສະຖານທີ່ ທຳ ລາຍ. ຢາຕ້ານເຊື້ອສາມາດລຶກລັບເຂົ້າໄປໃນຊ່ອງ intercellular ຫຼືມີການສ້ອມແຊມຢູ່ໃນເຍື່ອຂອງ ly-lymphocytes ພິເສດທີ່ເອີ້ນວ່າ plasmocytes.
ການເຮັດວຽກຕາມລະບຽບ
ຂະບວນການຫຼາຍຢ່າງພາຍໃນຈຸລັງຖືກຄວບຄຸມໂດຍໂມເລກຸນທາດໂປຼຕີນ, ເຊິ່ງບໍ່ໄດ້ເປັນແຫຼ່ງພະລັງງານຫລືກໍ່ສ້າງວັດສະດຸກໍ່ສ້າງ ສຳ ລັບຫ້ອງ. ທາດໂປຼຕີນເຫຼົ່ານີ້ຄວບຄຸມຄວາມກ້າວ ໜ້າ ຂອງເຊນໃນວົງຈອນຂອງຈຸລັງ, ການຖ່າຍທອດ, ການແປພາສາ, ການຊໍ້າຊ້ອນ, ກິດຈະ ກຳ ຂອງໂປຣຕີນອື່ນໆແລະຂະບວນການອື່ນໆຫຼາຍຢ່າງ. ທາດໂປຼຕີນເຮັດ ໜ້າ ທີ່ຄວບຄຸມບໍ່ວ່າຈະຍ້ອນກິດຈະ ກຳ enzymatic (ຕົວຢ່າງ kinases ທາດໂປຼຕີນ), ຫຼືຍ້ອນການຜູກມັດສະເພາະກັບໂມເລກຸນອື່ນໆ. ດັ່ງນັ້ນ, ປັດໃຈການຖ່າຍທອດ, ທາດໂປຼຕີນທີ່ເຄື່ອນໄຫວແລະທາດໂປຼຕີນທີ່ຍັບຍັ້ງ, ສາມາດຄວບຄຸມຄວາມຫນາແຫນ້ນຂອງການໂອນຍ້າຍຂອງພັນທຸກໍາໂດຍການຜູກມັດກັບລະບຽບການຂອງມັນ. ໃນລະດັບການແປ, ການອ່ານ mRNA ຫຼາຍຢ່າງຍັງຖືກຄວບຄຸມດ້ວຍການເພີ່ມປັດໃຈທາດໂປຼຕີນ.
ບົດບາດ ສຳ ຄັນທີ່ສຸດໃນລະບຽບການຂອງຂະບວນການ intracellular ແມ່ນຫຼີ້ນໂດຍ kinases ທາດໂປຼຕີນແລະ phosphatases ທາດໂປຼຕີນ - enzymes ທີ່ກະຕຸ້ນຫຼືຍັບຍັ້ງກິດຈະ ກຳ ຂອງໂປຣຕີນອື່ນໆໂດຍຕິດກັບພວກມັນຫຼືແຍກກຸ່ມຟອສເຟດ.

ຟັງຊັນສັນຍານ
ການ ທຳ ງານຂອງສັນຍານຂອງໂປຣຕີນແມ່ນຄວາມສາມາດຂອງໂປຣຕີນທີ່ເປັນສານທີ່ສົ່ງສັນຍານ, ສົ່ງສັນຍານລະຫວ່າງຈຸລັງ, ເນື້ອເຍື່ອ, ອະໄວຍະວະແລະສິ່ງມີຊີວິດ. ປົກກະຕິແລ້ວ, ການ ທຳ ງານຂອງສັນຍານໄດ້ຖືກລວມເຂົ້າກັບລະບຽບການ ໜຶ່ງ, ເນື່ອງຈາກວ່າໂປຣຕີນທີ່ຄວບຄຸມແບບບໍ່ມີຕົວຕົນຫຼາຍຕົວກໍ່ສົ່ງສັນຍານ.
ການ ທຳ ງານຂອງສັນຍານແມ່ນປະຕິບັດໂດຍໂປຣຕີນຮໍໂມນ, cytokines, ປັດໄຈການຈະເລີນເຕີບໂຕ, ອື່ນໆ.
ຮໍໂມນຖືກປະຕິບັດໂດຍເລືອດ. ຮໍໂມນສັດສ່ວນໃຫຍ່ແມ່ນທາດໂປຼຕີນຫຼື peptides. ການຜູກມັດຂອງຮໍໂມນກັບຕົວຮັບຂອງມັນແມ່ນສັນຍານທີ່ເຮັດໃຫ້ເກີດການຕອບສະ ໜອງ ຂອງເຊນ. ຮໍໂມນຄວບຄຸມຄວາມເຂັ້ມຂົ້ນຂອງສານໃນເລືອດແລະຈຸລັງ, ການຈະເລີນເຕີບໂຕ, ການສືບພັນແລະຂະບວນການອື່ນໆ. ຕົວຢ່າງຂອງທາດໂປຼຕີນດັ່ງກ່າວແມ່ນອິນຊູລິນ, ເຊິ່ງຄວບຄຸມຄວາມເຂັ້ມຂົ້ນຂອງນ້ ຳ ຕານໃນເລືອດ.
ຈຸລັງເຊື່ອມຕໍ່ເຊິ່ງກັນແລະກັນໂດຍໃຊ້ໂປຣຕີນທີ່ເປັນສັນຍານທີ່ສົ່ງຕໍ່ຜ່ານສານ intercellular. ທາດໂປຼຕີນດັ່ງກ່າວປະກອບມີ, ຍົກຕົວຢ່າງ, cytokines ແລະປັດໃຈການເຕີບໂຕ.
Cytokines ແມ່ນໂມເລກຸນທີ່ມີສັນຍານ peptide. ພວກເຂົາຄວບຄຸມການຕິດຕໍ່ພົວພັນລະຫວ່າງຈຸລັງ, ກຳ ນົດການຢູ່ລອດຂອງມັນ, ກະຕຸ້ນຫຼືຍັບຍັ້ງການຈະເລີນເຕີບໂຕ, ຄວາມແຕກຕ່າງ, ກິດຈະ ກຳ ທີ່ມີປະໂຫຍດແລະ apoptosis, ຮັບປະກັນການປະສານງານຂອງລະບົບພູມຕ້ານທານ, endocrine ແລະລະບົບປະສາດ. ຕົວຢ່າງຂອງ cytokines ແມ່ນປັດໃຈໂຣກ necrosis, ເຊິ່ງສົ່ງສັນຍານອັກເສບລະຫວ່າງຈຸລັງຂອງຮ່າງກາຍ.
ຫນ້າທີ່ spare (ສະແຕນບາຍ)
ທາດໂປຼຕີນດັ່ງກ່າວປະກອບມີທາດໂປຼຕີນທີ່ສະຫງວນໄວ້, ເຊິ່ງຖືກເກັບຮັກສາໄວ້ເປັນແຫລ່ງພະລັງງານແລະສານໃນເມັດພັນຂອງພືດ (ຕົວຢ່າງ, 7S ແລະ 11S globulins) ແລະໄຂ່ສັດ. ທາດໂປຼຕີນອື່ນໆ ຈຳ ນວນ ໜຶ່ງ ຖືກ ນຳ ໃຊ້ໃນຮ່າງກາຍເປັນແຫຼ່ງຂອງອາຊິດ amino, ເຊິ່ງໃນເບື້ອງຕົ້ນແມ່ນສານທີ່ມີການເຄື່ອນໄຫວທາງຊີວະວິທະຍາທີ່ຄວບຄຸມຂະບວນການທາງເດີນອາຫານ.

ຕຳ ແໜ່ງ Receptor
ຕົວຮັບທາດໂປຼຕີນສາມາດຕັ້ງຢູ່ທັງໃນ cytoplasm ແລະປະສົມເຂົ້າໄປໃນເຍື່ອຂອງຈຸລັງ. ສ່ວນ ໜຶ່ງ ຂອງໂມເລກຸນທີ່ຮັບໄດ້ຮັບສັນຍານ, ເຊິ່ງສ່ວນຫຼາຍແມ່ນໃຊ້ສານເຄມີ, ແລະໃນບາງກໍລະນີ - ຄວາມສະຫວ່າງ, ຄວາມກົດດັນກົນຈັກ (ຕົວຢ່າງ, ການຍືດຕົວ) ແລະການກະຕຸ້ນອື່ນໆ. ໃນເວລາທີ່ສັນຍານທີ່ຖືກເປີດເຜີຍກັບສ່ວນສະເພາະໃດຫນຶ່ງຂອງໂມເລກຸນ - ທາດໂປຼຕີນທີ່ຮັບ - ການປ່ຽນແປງທີ່ສອດຄ່ອງຂອງມັນເກີດຂື້ນ. ດັ່ງນັ້ນ, ຄວາມສອດຄ່ອງຂອງພາກສ່ວນອື່ນຂອງໂມເລກຸນ, ທີ່ສົ່ງສັນຍານໄປຫາສ່ວນປະກອບອື່ນໆຂອງຈຸລັງ, ການປ່ຽນແປງ. ມີກົນໄກການສົ່ງສັນຍານຫຼາຍຢ່າງ. ບາງຕົວຮັບສານເຄມີກະຕຸ້ນປະຕິກິລິຍາເຄມີບາງຢ່າງ, ສ່ວນອື່ນໆເຮັດ ໜ້າ ທີ່ເປັນຊ່ອງທາງ ion, ເຊິ່ງເປີດຫລືປິດການກະ ທຳ ຂອງສັນຍານ, ໃນຂະນະທີ່ຄົນອື່ນຜູກມັດໂມເລກຸນໄກ່ເກ່ຍແບບພິເສດ. ຢູ່ທີ່ເລື່ອຍເຍື່ອ, ສ່ວນຂອງໂມເລກຸນທີ່ຜູກກັບໂມເລກຸນສັນຍານແມ່ນຢູ່ດ້ານ ໜ້າ ຂອງຫ້ອງ, ແລະໂດເມນທີ່ສົ່ງສັນຍານຢູ່ພາຍໃນ.
ໜ້າ ທີ່ມໍເຕີ (ມໍເຕີ)
ທາດໂປຼຕີນຈາກມໍເຕີ້ທັງ ໝົດ ປະກອບໃຫ້ການເຄື່ອນໄຫວຂອງຮ່າງກາຍ, ຕົວຢ່າງ, ການຫົດຕົວຂອງກ້າມເນື້ອ, ລວມທັງການເຄື່ອນຍ້າຍຂອງທ້ອງຖິ່ນ (myosin), ການເຄື່ອນໄຫວຂອງຈຸລັງພາຍໃນຮ່າງກາຍ (ຕົວຢ່າງ, ການເຄື່ອນຍ້າຍຂອງ amoeboid ຂອງ leukocytes), ການເຄື່ອນໄຫວຂອງ cilia ແລະ flagella, ເຊັ່ນດຽວກັນກັບການຂົນສົ່ງທີ່ມີການເຄື່ອນໄຫວແລະກະຕຸ້ນໂດຍກົງ (kinesin, dynein) . Dyneins ແລະ kinesins ຂົນສົ່ງໂມເລກຸນຕາມ microtubules ໂດຍໃຊ້ ATP hydrolysis ເປັນແຫຼ່ງພະລັງງານ. Dyneins ໂອນໂມເລກຸນແລະອະໄວຍະວະຕ່າງໆອອກຈາກສ່ວນຕ່າງໆຂອງຫ້ອງໄປຫາສູນ, kinesins - ໃນທິດທາງກົງກັນຂ້າມ. Dyneins ຍັງມີຄວາມຮັບຜິດຊອບຕໍ່ການເຄື່ອນໄຫວຂອງ cilia ແລະ flagella ຂອງ eukaryotes. ຕົວປ່ຽນແປງຂອງ Cytoplasmic ຂອງ myosin ສາມາດມີສ່ວນຮ່ວມໃນການຂົນສົ່ງໂມເລກຸນແລະທາດອະໄວຍະວະຕ່າງໆຜ່ານ microfilaments.
ທາດໂປຼຕີນໃນ metabolism
ຈຸລິນຊີແລະພືດສ່ວນໃຫຍ່ສາມາດສັງເຄາະອາຊິດ amino 20 ມາດຕະຖານເຊັ່ນດຽວກັນກັບກົດອະມິໂນ (ເພີ່ມເຕີມທີ່ບໍ່ແມ່ນມາດຕະຖານ) ເຊັ່ນ citrulline.ແຕ່ຖ້າກົດອະມິໂນຢູ່ໃນສະພາບແວດລ້ອມ, ແມ້ກະທັ້ງຈຸລິນຊີກໍ່ຈະຮັກສາພະລັງງານໂດຍການຂົນສົ່ງກົດອະມິໂນເຂົ້າໄປໃນຈຸລັງແລະປິດເສັ້ນທາງຊີວະພາບ.
ອາຊິດ amino ທີ່ບໍ່ສາມາດສັງເຄາະໄດ້ຈາກສັດແມ່ນສິ່ງທີ່ ຈຳ ເປັນ. Enzymes ຕົ້ນຕໍໃນເສັ້ນທາງຊີວະວິທະຍາ, ຍົກຕົວຢ່າງ, aspartate kinase, ເຊິ່ງ catalyzes ຂັ້ນຕອນທໍາອິດໃນການສ້າງຕັ້ງຂອງ lysine, methionine ແລະ threonine ຈາກ aspartate, ແມ່ນບໍ່ມີສັດ.
ສັດສ່ວນໃຫຍ່ຈະໄດ້ຮັບອາຊິດ amino ຈາກໂປຣຕີນທີ່ພົບໃນອາຫານ. ທາດໂປຼຕີນຖືກ ທຳ ລາຍໃນລະຫວ່າງການຍ່ອຍອາຫານເຊິ່ງມັກຈະເລີ່ມຕົ້ນດ້ວຍທາດໂປຼຕິນທີ່ເຮັດໃຫ້ເສີຍເມີຍໂດຍການວາງມັນຢູ່ໃນສະພາບແວດລ້ອມທີ່ເປັນກົດແລະເຮັດໃຫ້ມັນຊຸ່ມຊື່ນໂດຍໃຊ້ເອນໄຊທີ່ເອີ້ນວ່າໂປຣໂມຊັ່ນ. ກົດອະມິໂນບາງຊະນິດທີ່ໄດ້ຮັບຈາກການຍ່ອຍອາຫານແມ່ນໃຊ້ ສຳ ລັບການສັງເຄາະທາດໂປຣຕີນໃນຮ່າງກາຍ, ສ່ວນທີ່ເຫຼືອແມ່ນປ່ຽນເປັນນ້ ຳ ຕານໃນລະຫວ່າງ gluconeogenesis ຫຼືຖືກ ນຳ ໃຊ້ໃນວົງຈອນ Krebs. ການ ນຳ ໃຊ້ທາດໂປຼຕີນເປັນແຫຼ່ງພະລັງງານແມ່ນມີຄວາມ ສຳ ຄັນເປັນພິເສດໃນເງື່ອນໄຂຂອງການຖືສິນອົດເຂົ້າ, ເມື່ອໂປຣຕີນຂອງຮ່າງກາຍ, ໂດຍສະເພາະກ້າມຊີ້ນ, ເປັນແຫຼ່ງພະລັງງານ. ອາຊິດ amino ຍັງເປັນແຫລ່ງໄນໂຕຣເຈນທີ່ ສຳ ຄັນໃນສານອາຫານຂອງຮ່າງກາຍ.
ບໍ່ມີມາດຕະຖານທີ່ເປັນເອກະພາບໃນການໄດ້ຮັບທາດໂປຼຕີນຈາກມະນຸດ. microflora ຂອງລໍາໄສ້ໃຫຍ່ສັງເຄາະອາຊິດ amino ທີ່ບໍ່ໄດ້ຖືກເອົາໃຈໃສ່ໃນການກະກຽມມາດຕະຖານຂອງທາດໂປຼຕີນ.
ວິທີການສຶກສາ
ໂຄງສ້າງແລະ ໜ້າ ທີ່ຂອງໂປຣຕີນແມ່ນໄດ້ສຶກສາທັງການກະກຽມເຮັດໃຫ້ບໍລິສຸດ ໃນ vitro, ແລະໃນສະພາບແວດລ້ອມ ທຳ ມະຊາດຂອງພວກມັນໃນສິ່ງມີຊີວິດ, ໃນ vivo. ການສຶກສາທາດໂປຼຕີນທີ່ບໍລິສຸດພາຍໃຕ້ສະພາບການຄວບຄຸມແມ່ນມີປະໂຫຍດ ສຳ ລັບການ ກຳ ນົດ ໜ້າ ທີ່ຂອງມັນ: ຄຸນລັກສະນະ kinetic ຂອງກິດຈະ ກຳ ທີ່ຊ່ວຍໃນການເຄື່ອນໄຫວຂອງເອນໄຊ, ຄວາມ ສຳ ພັນທີ່ກ່ຽວຂ້ອງ ສຳ ລັບອະນຸພາກຕ່າງໆ, ແລະອື່ນໆ. ໃນ vivo ຢູ່ໃນຈຸລັງຫຼືໃນອົງການຈັດຕັ້ງທັງ ໝົດ ໃຫ້ຂໍ້ມູນເພີ່ມເຕີມກ່ຽວກັບບ່ອນທີ່ພວກມັນເຮັດວຽກແລະວິທີການເຄື່ອນໄຫວຂອງພວກມັນ.
ຊີວະວິທະຍາໂມເລກຸນແລະເຊນ

ວິທີການຊີວະວິທະຍາໂມເລກຸນແລະຈຸລັງໂດຍທົ່ວໄປແມ່ນໃຊ້ເພື່ອສຶກສາການສັງເຄາະແລະການແປສັບທ້ອງຖິ່ນຂອງໂປຣຕີນໃນຫ້ອງ. ວິທີການຮຽນພາສາທ້ອງຖິ່ນແມ່ນຖືກ ນຳ ໃຊ້ຢ່າງກວ້າງຂວາງ, ໂດຍອີງໃສ່ການສັງເຄາະທາດໂປຼຕີນຈາກ chim chim ໃນຫ້ອງ, ປະກອບດ້ວຍໂປຣຕີນທີ່ໄດ້ສຶກສາ, ເຊື່ອມຕໍ່ກັບ "ນັກຂ່າວ", ຍົກຕົວຢ່າງ, ທາດໂປຼຕີນຈາກແສງສີຂຽວ (GFP). ສະຖານທີ່ຂອງທາດໂປຼຕີນດັ່ງກ່າວຢູ່ໃນຫ້ອງສາມາດເບິ່ງເຫັນໄດ້ໂດຍໃຊ້ກ້ອງຈຸລະທັດດອກໄຟຟ້າ. ນອກຈາກນັ້ນ, ທາດໂປຼຕີນສາມາດເບິ່ງເຫັນໄດ້ໂດຍໃຊ້ພູມຕ້ານທານທີ່ຮັບຮູ້ມັນ, ເຊິ່ງໃນທາງກັບກັນມີປ້າຍ fluorescent. ປົກກະຕິແລ້ວ, ພ້ອມໆກັນກັບທາດໂປຼຕີນທີ່ ກຳ ລັງສຶກສາ, ທາດໂປຼຕີນທີ່ຮູ້ຈັກຂອງອົງການຈັດຕັ້ງເຊັ່ນ endoplasmic reticulum, ອຸປະກອນ Golgi, lysosomes ແລະ vacuoles ແມ່ນໄດ້ຮັບການເບິ່ງເຫັນ, ເຊິ່ງເຮັດໃຫ້ມັນສາມາດ ກຳ ນົດທ້ອງຖິ່ນຂອງທາດໂປຼຕີນທີ່ ກຳ ລັງສຶກສາຢູ່.
ວິທີການ Immunohistochemical ປົກກະຕິແລ້ວແມ່ນໃຊ້ພູມຕ້ານທານທີ່ປະສົມເຂົ້າກັບເອນໄຊທີ່ຊ່ວຍກະຕຸ້ນການສ້າງຜະລິດຕະພັນ luminescent ຫຼືສີ, ເຊິ່ງຊ່ວຍໃຫ້ທ່ານສາມາດປຽບທຽບທ້ອງຖິ່ນແລະ ຈຳ ນວນໂປຼຕີນທີ່ໄດ້ສຶກສາໃນຕົວຢ່າງ. ເຕັກນິກທີ່ຫາຍາກກວ່າ ສຳ ລັບການ ກຳ ນົດ ຕຳ ແໜ່ງ ຂອງໂປຣຕີນແມ່ນການສົມດຸນຂອງທາດໂປຼຕີນຈາກຈຸລັງທີ່ມີສ່ວນປະກອບໃນສ່ວນຂອງ gracrient ຂອງ sucrose ຫຼື cesium chloride.
ສຸດທ້າຍ, ໜຶ່ງ ໃນວິທີການແບບເກົ່າແກ່ແມ່ນກ້ອງຈຸລະທັດພູມຕ້ານທານ, ເຊິ່ງມີພື້ນຖານຄ້າຍຄືກັນກັບກ້ອງຈຸລະທັດພູມຕ້ານທານດ້ວຍຄວາມແຕກຕ່າງທີ່ກ້ອງຈຸລະທັດເອເລັກໂຕຣນິກຖືກໃຊ້. ຕົວຢ່າງຖືກກະກຽມ ສຳ ລັບກ້ອງຈຸລະທັດອິເລັກໂທຣນິກ, ແລະຈາກນັ້ນກໍ່ປະມວນຜົນດ້ວຍພູມຕ້ານທານກັບໂປຕີນທີ່ເຊື່ອມຕໍ່ກັບວັດສະດຸທີ່ມີຄວາມ ໜາ ແໜ້ນ ຂອງເອເລັກໂຕຣນິກ, ໂດຍປົກກະຕິແລ້ວແມ່ນ ຄຳ.
ການ ນຳ ໃຊ້ mutagenesis ທີ່ ນຳ ໃຊ້ໃນເວັບໄຊທ໌້, ນັກຄົ້ນຄວ້າສາມາດປ່ຽນ ລຳ ດັບທາດອາຊິດ amino ຂອງທາດໂປຼຕີນແລະດັ່ງນັ້ນ, ໂຄງສ້າງທາງກວ້າງຂອງພື້ນທີ່, ສະຖານທີ່ໃນຫ້ອງແລະລະບຽບການຂອງກິດຈະ ກຳ ຂອງມັນ. ການ ນຳ ໃຊ້ວິທີການນີ້, ການ ນຳ ໃຊ້ tRNA ທີ່ຖືກປັບປ່ຽນແລ້ວ, ກົດອະມິໂນທຽມກໍ່ສາມາດ ນຳ ສະ ເໜີ ເຂົ້າໃນໂປຣຕີນແລະໂປຣຕີນທີ່ມີຄຸນສົມບັດ ໃໝ່ ສາມາດສ້າງໄດ້.
ຊີວະເຄມີ
ເພື່ອປະຕິບັດການວິເຄາະ ໃນ vitro ທາດໂປຼຕີນຕ້ອງໄດ້ຮັບການບໍລິສຸດຈາກສ່ວນປະກອບອື່ນໆ. ຂະບວນການນີ້ມັກຈະເລີ່ມຕົ້ນດ້ວຍການ ທຳ ລາຍຈຸລັງແລະການໄດ້ຮັບສານສະກັດຈາກເຊນທີ່ເອີ້ນວ່າ. ຍິ່ງໄປກວ່ານັ້ນ, ໂດຍວິທີການ centrifugation ແລະ ultracentrifugation, ສານສະກັດຈາກນີ້ສາມາດແບ່ງອອກເປັນ: ສ່ວນປະກອບທີ່ມີທາດໂປຼຕີນທີ່ລະລາຍ, ສ່ວນທີ່ມີສ່ວນປະກອບຂອງ lipids ເຍື່ອແລະທາດໂປຼຕີນ, ແລະສ່ວນທີ່ມີສ່ວນປະກອບຂອງຈຸລິນຊີ cellular ແລະກົດ nucleic.

precipitation ທາດໂປຼຕີນໂດຍ salting ອອກແມ່ນຖືກນໍາໃຊ້ເພື່ອແຍກປະສົມທາດໂປຼຕີນ, ແລະຍັງອະນຸຍາດໃຫ້ຄວາມເຂັ້ມຂົ້ນຂອງທາດໂປຼຕີນ. ການວິເຄາະ Sedimentation (centrifugation) ຊ່ວຍໃຫ້ທ່ານສາມາດແບ່ງສ່ວນປະສົມທາດໂປຼຕີນຈາກມູນຄ່າຂອງການຕົກຕະກອນຄົງທີ່ຂອງທາດໂປຼຕີນສ່ວນບຸກຄົນ, ວັດແທກໃນ svedbergs (S). ປະເພດ chromatography ປະເພດຕ່າງໆໄດ້ຖືກ ນຳ ໃຊ້ເພື່ອແຍກທາດໂປຼຕີນຫຼືທາດໂປຼຕີນທີ່ຕ້ອງການໂດຍອີງໃສ່ຄຸນລັກສະນະຕ່າງໆເຊັ່ນ: ນ້ ຳ ໜັກ ໂມເລກຸນ, ຮັບຜິດຊອບແລະຄວາມຮັກແພງ. ນອກຈາກນັ້ນ, ທາດໂປຼຕີນສາມາດຖືກແຍກອອກໄປຕາມຄວາມຮັບຜິດຊອບຂອງພວກເຂົາໂດຍໃຊ້ electrofocus.
ເພື່ອເຮັດໃຫ້ຂັ້ນຕອນການ ຊຳ ລະໂປຕີນງ່າຍຂື້ນ, ວິສະວະ ກຳ ພັນທຸ ກຳ ມັກຖືກ ນຳ ໃຊ້, ເຊິ່ງຊ່ວຍໃຫ້ທ່ານສາມາດສ້າງອະນຸພັນຂອງທາດໂປຣຕີນທີ່ສະດວກຕໍ່ການເຮັດຄວາມບໍລິສຸດໂດຍບໍ່ມີຜົນກະທົບຕໍ່ໂຄງສ້າງຫລືກິດຈະ ກຳ ຂອງມັນ. "ປ້າຍຊື່", ເຊິ່ງແມ່ນລໍາດັບກົດອາມີ amino ຂະ ໜາດ ນ້ອຍ, ຍົກຕົວຢ່າງ, ເປັນຕ່ອງໂສ້ຂອງສານຕົກຄ້າງຂອງທາດໂປຼຕີນຈາກ 6 ຫຼືຫຼາຍກວ່ານັ້ນ, ແລະຕິດຢູ່ປາຍ ໜຶ່ງ ຂອງໂປຕີນ. ເມື່ອສານສະກັດຂອງຈຸລັງການສັງເຄາະທາດໂປຼຕີນທີ່“ ຕິດສະຫລາກ” ຖືກສົ່ງຜ່ານຖັນ chromatographic ທີ່ບັນຈຸທາດໄອນິກນິກນິກ, histidine ຜູກພັນກັບນິກແກນແລະຍັງຄົງຢູ່ໃນຖັນ, ປ້າຍອື່ນໆ ຈຳ ນວນຫຼາຍຖືກອອກແບບມາເພື່ອຊ່ວຍນັກຄົ້ນຄວ້າແຍກໂປຣຕີນສະເພາະຈາກຜະສົມຜະສານທີ່ສັບສົນ, ສ່ວນຫຼາຍມັກໃຊ້ສັບພະ ໜັງ ສືທີ່ກ່ຽວຂ້ອງ.
ລະດັບຂອງການກັ່ນຕອງທາດໂປຼຕີນສາມາດ ກຳ ນົດໄດ້ຖ້າວ່ານໍ້າ ໜັກ ໂມເລກຸນຂອງມັນແລະຈຸດ isoelectric ເປັນທີ່ຮູ້ຈັກ - ໂດຍໃຊ້ gel electrophoresis ປະເພດຕ່າງໆ - ຫລືໂດຍການວັດແທກກິດຈະ ກຳ ຂອງເອນໄຊຖ້າທາດໂປຼຕີນດັ່ງກ່າວເປັນເອນໄຊ. ມະຫາສະມຸດມະຫາຊົນຊ່ວຍໃຫ້ທ່ານສາມາດ ຈຳ ແນກທາດໂປຼຕີນທີ່ຖືກຄັດເລືອກໂດຍນ້ ຳ ໜັກ ໂມເລກຸນແລະມວນຂອງຊິ້ນສ່ວນຂອງມັນ.
ໂປຣຕີນ
ຈໍານວນທັງຫມົດຂອງທາດໂປຼຕີນຈາກຈຸລັງຖືກເອີ້ນວ່າເປັນໂປຣຕີນ, ການສຶກສາຂອງມັນ - proteomics, ເອີ້ນວ່າໂດຍການປຽບທຽບກັບ genomics. ວິທີການທົດລອງໂປຣແກຣມທົດລອງຕົ້ນຕໍລວມມີ:
- 2D electrophoresis, ເຊິ່ງຊ່ວຍໃຫ້ມີການແຍກທາດໂປຼຕີນຈາກທາດໂປຼຕີນຈາກ multicomponent,
- ມະຫາສະມຸດມະຫາສານ, ເຊິ່ງອະນຸຍາດໃຫ້ລະບຸໂປຣຕີນໂດຍມວນສານຂອງສ່ວນປະກອບຂອງພວກມັນທີ່ມີສ່ວນປະກອບສູງ,
- microarrays ທາດໂປຼຕີນ, ເຊິ່ງຊ່ວຍໃຫ້ທ່ານສາມາດວັດແທກເນື້ອໃນຂອງໂປຣຕີນ ຈຳ ນວນຫລາຍໃນຈຸລັງ,
- ລະບົບເຊື້ອລາສອງຊະນິດ , ເຊິ່ງຊ່ວຍໃຫ້ທ່ານສາມາດສຶກສາລະບົບປະຕິ ສຳ ພັນທາດໂປຼຕີນ - ທາດໂປຼຕີນ.
ລວມທັງ ໝົດ ຂອງການໂຕ້ຕອບທີ່ ສຳ ຄັນທາງດ້ານຊີວະວິທະຍາຂອງໂປຣຕີນໃນຈຸລັງເອີ້ນວ່າການໂຕ້ຕອບ. ການສຶກສາຢ່າງເປັນລະບົບກ່ຽວກັບໂຄງສ້າງຂອງໂປຣຕີນທີ່ເປັນຕົວແທນໃຫ້ແກ່ທຸກໆປະເພດທີ່ເປັນໄປໄດ້ຂອງໂຄງສ້າງຂັ້ນສາມເອີ້ນວ່າ genomics ໂຄງສ້າງ.
ການຄາດຄະເນໂຄງສ້າງແລະແບບ ຈຳ ລອງ
ການຄາດເດົາຂອງໂຄງສ້າງທາງກວ້າງຂອງພື້ນທີ່ໂດຍ ນຳ ໃຊ້ໂປແກຼມຄອມພິວເຕີ (ໃນ silico) ອະນຸຍາດໃຫ້ສ້າງແບບ ຈຳ ລອງທາດໂປຼຕີນທີ່ໂຄງສ້າງຍັງບໍ່ທັນໄດ້ ກຳ ນົດໃນຂັ້ນທົດລອງ. ການຄາດຄະເນໂຄງສ້າງທີ່ປະສົບຜົນ ສຳ ເລັດຫຼາຍທີ່ສຸດ, ເຊິ່ງເອີ້ນວ່າການສ້າງແບບ ຈຳ ລອງແບບ homological, ແມ່ນອີງໃສ່ໂຄງສ້າງ“ ແມ່ແບບ” ທີ່ມີຢູ່, ຄ້າຍຄືກັນກັບ ລຳ ດັບອາຊິດ amino ກັບທາດໂປຼຕີນທີ່ ຈຳ ລອງ. ວິທີການໃນການຄາດຄະເນໂຄງສ້າງທາງກວ້າງຂອງພື້ນຂອງໂປຣຕີນໄດ້ຖືກ ນຳ ໃຊ້ເຂົ້າໃນການພັດທະນາວິສະວະ ກຳ ພັນທຸ ກຳ ຂອງໂປຣຕີນ, ໂດຍການຊ່ວຍເຫຼືອຂອງໂຄງສ້າງທາດໂປຼຕີນຂັ້ນສູງ ໃໝ່ ໄດ້ຮັບແລ້ວ. ໜ້າ ທີ່ການປຽບທຽບທີ່ມີຄວາມສັບສົນກວ່ານັ້ນແມ່ນການຄາດຄະເນຂອງການໂຕ້ຕອບແບບ intermolecular, ເຊັ່ນວ່າການໂມເລກຸນໂມເລກຸນແລະການຄາດຄະເນການພົວພັນກັບທາດໂປຼຕີນ - ທາດໂປຼຕີນ.
ປະຕິກິລິຍາພັບແລະສ່ວນປະກອບ intermolecular ຂອງທາດໂປຼຕີນສາມາດຖືກສ້າງແບບຈໍາລອງໂດຍໃຊ້ກົນຈັກໂມເລກຸນ. , ໂດຍສະເພາະ, ແບບເຄື່ອນໄຫວໂມເລກຸນແລະວິທີການ Monte Carlo, ເຊິ່ງໄດ້ຮັບປະໂຫຍດຈາກຄອມພິວເຕີ້ແບບຂະ ໜານ ແລະແຈກຢາຍ (ຕົວຢ່າງ, ໂຄງການເຮືອນ Folding @).ການພັບຂອງໂດເມນທາດໂປຼຕີນນ້ອຍໆທີ່ມີປະສິດຕິພາບ, ເຊັ່ນວ່າໂປຣຕີນຂອງ villin ຫຼື ໜຶ່ງ ໃນໂປຣຕີນເອດສ໌ໄດ້ຖືກສ້າງແບບຢ່າງໃຫ້ປະສົບຜົນ ສຳ ເລັດ. ໃນ silico. ການ ນຳ ໃຊ້ວິທີການປະສົມທີ່ປະສົມແບບເຄື່ອນໄຫວໂມເລກຸນມາດຕະຖານກັບກົນຈັກ quantum, ລັດອີເລັກໂທຣນິກຂອງໂລດເມັດສີທີ່ເຫັນໄດ້ຖືກກວດສອບແລ້ວ.