Biosynthesis Cholesterol ແລະທາດຊີວະເຄມີ - ພະຍາດເບົາຫວານ
ໂດຍບໍ່ຕ້ອງສົງໃສ, cholesterol ແມ່ນສານ lipid ທີ່ຮູ້ກັນດີທີ່ສຸດຕໍ່ປະຊາຊົນທົ່ວໄປ; ມັນບໍ່ມີຊື່ສຽງເພາະວ່າມັນມີຄວາມ ສຳ ພັນກັນລະຫວ່າງຄໍເລສເຕີໂຣນໃນເລືອດສູງແລະຄວາມຖີ່ຂອງພະຍາດຫລອດເລືອດໃນຄົນ. ການເອົາໃຈໃສ່ ໜ້ອຍ ລົງແມ່ນໄດ້ເອົາໃຈໃສ່ເຖິງບົດບາດທີ່ ສຳ ຄັນຂອງ cholesterol ເຊິ່ງເປັນສ່ວນປະກອບຂອງເຍື່ອຫຸ້ມຈຸລັງແລະເປັນຕົວເຕືອນ ສຳ ລັບຮໍໂມນສະເຕີຣອຍແລະກົດອາຊິດບີ. ທາດ Cholesterol ແມ່ນມີຄວາມ ຈຳ ເປັນ ສຳ ລັບສັດ ຈຳ ນວນຫຼາຍ, ລວມທັງມະນຸດ, ແຕ່ວ່າມັນມີຢູ່ໃນອາຫານສັດລ້ຽງລູກດ້ວຍນົມແມ່ນເປັນທາງເລືອກ - ຈຸລັງຂອງຮ່າງກາຍເອງກໍ່ສາມາດສັງເຄາະມັນໄດ້ຈາກເຄື່ອງປະດັບທີ່ງ່າຍດາຍ.
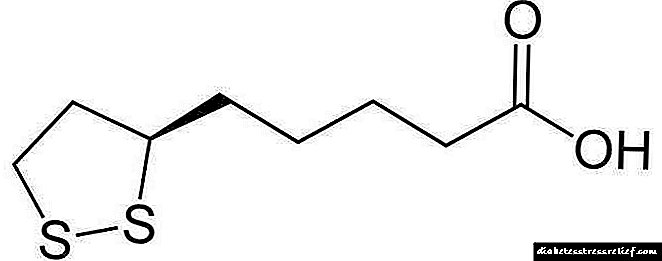
ໂຄງປະກອບຂອງສານປະສົມກາກບອນ 27 ໜ່ວຍ ນີ້ຊີ້ໃຫ້ເຫັນເສັ້ນທາງທີ່ສັບສົນ ສຳ ລັບການຜະລິດສານເຄມີຊີວະພາບ, ແຕ່ວ່າທັງ ໝົດ ຂອງອະຕອມຂອງກາກບອນຂອງມັນແມ່ນສະ ໜອງ ໃຫ້ໂດຍຄາຣະວາດຽວ - ອາຊີຕາ. ຕັນ Isoprene - ຕົວກາງທີ່ ສຳ ຄັນທີ່ສຸດຈາກສານອາເຊຊຽມຫາຄໍເລສເຕີຣອນ, ພວກມັນແມ່ນຕົວ ນຳ ຂອງ lipid ທຳ ມະຊາດຫຼາຍຊະນິດ, ແລະກົນໄກຕ່າງໆທີ່ຕັນ isoprene ຖືກທາດໂປຼຕຽມເຮັດແມ່ນຄ້າຍຄືກັນໃນທຸກໆເສັ້ນທາງການເຜົາຜະຫລານອາຫານ.
ພວກເຮົາເລີ່ມຕົ້ນໂດຍການກວດກາໄລຍະຕົ້ນຕໍໃນເສັ້ນທາງຂອງການຮັກສາໄຂມັນ biosynthesis ຈາກອາເຊຕາໄຊຕ໌, ຫຼັງຈາກນັ້ນປຶກສາຫາລືກ່ຽວກັບການຂົນສົ່ງ cholesterol ໂດຍຜ່ານກະແສເລືອດ, ການດູດຊືມຂອງມັນໂດຍຈຸລັງ, ລະບຽບການປົກກະຕິຂອງການສັງເຄາະ cholesterol, ແລະລະບຽບການໃນກໍລະນີຂອງການດູດຊືມຫຼືການຂົນສົ່ງທີ່ບົກຜ່ອງ. ຈາກນັ້ນພວກເຮົາເບິ່ງສານອື່ນໆທີ່ມາຈາກລະດັບຄໍເລສເຕີໂຣນ, ເຊັ່ນວ່າກົດອາຊິດບີແລະຮໍໂມນສະເຕີຣອຍ. ສຸດທ້າຍ, ຄຳ ອະທິບາຍກ່ຽວກັບເສັ້ນທາງຊີວະວິທະຍາ ສຳ ລັບການສ້າງສານປະກອບຫຼາຍຢ່າງ - ອະນຸພັນຂອງທ່ອນໄມ້ isoprene, ໃນນັ້ນມີໄລຍະ ທຳ ມະດາທີ່ມີການສັງເຄາະ cholesterol, ຈະສະແດງໃຫ້ເຫັນເຖິງຄວາມສາມາດພິເສດຂອງການຍ່ອຍສະຫຼາຍຂອງ isoprenoid ໃນການຜະລິດສານຊີວະພາບ.
Cholesterol ແມ່ນຜະລິດຈາກ acetyl-CoA ເປັນ 4 ໄລຍະ
Cholesterol ເຊັ່ນ: ກົດໄຂມັນໃນຕ່ອງໂສ້ຍາວແມ່ນຜະລິດຈາກ acetyl-CoA, ແຕ່ຮູບແບບການປະກອບແມ່ນແຕກຕ່າງກັນຫມົດ. ໃນການທົດລອງຄັ້ງ ທຳ ອິດ, ສານອາເຊຕາມີນຕິກທີ່ຕິດດ້ວຍ 14 C ບໍ່ວ່າຈະຢູ່ທີ່ປະລິມານທາດ methyl ຫຼື carboxyl ກໍ່ຖືກເພີ່ມເຂົ້າໃນອາຫານສັດ. ອີງຕາມການແຈກຢາຍຂອງປ້າຍໃນ cholesterol ທີ່ແຍກອອກຈາກສອງກຸ່ມສັດ (ຮູບ 21-32), ໄລຍະທີ່ enzymatic ຂອງ biosynthesis cholesterol ໄດ້ຖືກອະທິບາຍ.
ຊາວ. -3 21- .2. ແຫຼ່ງທີ່ມາຂອງອະຕອມຄາບອນຂອງ cholesterol. ຖືກລະບຸໃນລະຫວ່າງການທົດລອງທີ່ໃຊ້ສານສະເຕີຣອຍທາດສີດນ້ ຳ ທີ່ຕິດປ້າຍດ້ວຍກາກບອນ methyl (ສີ ດຳ) ຫຼືຄາບອນ carboxyl (ສີແດງ). ໃນໂຄງສ້າງຂົ້ນ, ແຫວນແມ່ນ ໝາຍ ເຖິງໂດຍຕົວອັກສອນ A ເຖິງ D.

ການສັງເຄາະເກີດຂື້ນເປັນ 4 ໄລຍະ, ດັ່ງທີ່ສະແດງໃນຮູບ. 21-33: (1) ສານລະລາຍຂອງທາດເສດເຫຼືອ 3 ອາຊິດທີ່ຈະປະກອບເປັນກ້ອນກາກບອນໃນລະດັບກາງຂອງໂມວີໂດຕາ, (2) ການປ່ຽນ mevalonate ໃຫ້ເປັນກ້ອນ isoprene ທີ່ມີການເຄື່ອນໄຫວ, (3) ສານ polymerization ຂອງຫົກຫນ່ວຍ isoprene ກາກບອນເພື່ອສ້າງເປັນ squalene ເສັ້ນກາກບອນ 30, (4) ຮອບວຽນຂອງ squalene ເພື່ອປະກອບເປັນກ້ອນ ສີ່ແຫວນຂອງແກນສະເຕີຣອຍ, ປະຕິບັດຕາມໂດຍການປ່ຽນແປງຫຼາຍໆຢ່າງ (ການຜຸພັງ, ການໂຍກຍ້າຍຫຼືການເຄື່ອນຍ້າຍຂອງກຸ່ມ methyl) ດ້ວຍການສ້າງ cholesterol.
ຊາວ. -3 21-33. ຮູບພາບທົ່ວໄປຂອງ biosynthesis cholesterol. ສີ່ຂັ້ນຕອນຂອງການສັງເຄາະໄດ້ຖືກປຶກສາຫາລືໃນຂໍ້ຄວາມ. ທ່ອນໄມ້ Isoprene ໃນ squalene ແມ່ນຖືກ ໝາຍ ໂດຍສາຍສີແດງ.

ຂັ້ນຕອນ (1). ການສັງເຄາະຂອງ mevalonate ຈາກ acetate. ຂັ້ນຕອນ ທຳ ອິດຂອງການເຮັດ biosynthesis cholesterol ເຮັດໃຫ້ມີການສ້າງຜະລິດຕະພັນລະດັບກາງ mevalonate (ຮູບ 21-34). ໂມເລກຸນ acetyl CoA ທັງສອງຂົ້ນຈະຊ່ວຍໃຫ້ Acetoacetyl CoA, ເຊິ່ງຂົ້ນດ້ວຍໂມເລກຸນ acetyl CoA ທີສາມເພື່ອປະກອບເປັນທາດປະສົມກາກບອນຫົກ β-hydroxy-β-methylglutaryl-CoA (HM G -CoA). ທັງສອງປະຕິກິລິຍາ ທຳ ອິດນີ້ແມ່ນຖືກກະຕຸ້ນ thiolase ແລະ NM G -CoA synthase ຕາມ ລຳ ດັບ. Cytosolic NM G-CoA synthase ເສັ້ນທາງເດີນທາງເດີນອາກາດນີ້ແຕກຕ່າງຈາກທາດ isoenzyme mitochondrial ເຊິ່ງຊ່ວຍກະຕຸ້ນການສັງເຄາະຂອງ NM G -CoA ໃນລະຫວ່າງການສ້າງຕັ້ງອົງການ ketone (ເບິ່ງຮູບ 17-18).
ຊາວ. -3 21-44. ການສ້າງຕັ້ງຂອງ mevalonate ຈາກ acetyl-CoA. ແຫຼ່ງຂອງ C-1 ແລະ C-2 mevalonate ຈາກ acetyl-CoA ແມ່ນເນັ້ນໃນສີບົວ.

ປະຕິກິລິຍາທີສາມ ຈຳ ກັດຄວາມໄວຂອງຂະບວນການທັງ ໝົດ. ໃນມັນ, NM G -CoA ຖືກຫຼຸດລົງເປັນ mevalonate, ເຊິ່ງໃນແຕ່ລະໂມເລກຸນNА D PH ສະ ໜອງ ໄຟຟ້າສອງ ໜ່ວຍ. HMG-CoA reductase - ທາດໂປຼຕີນຈາກເຍື່ອເຊື່ອມຂອງ ER ກ້ຽງ, ມັນໃຫ້ບໍລິການ, ດັ່ງທີ່ພວກເຮົາຈະເຫັນໃນພາຍຫລັງ, ເປັນຈຸດຕົ້ນຕໍຂອງລະບຽບການຂອງເສັ້ນທາງການເຜົາຜະຫລານຂອງການສ້າງຄໍເລສເຕີຣອນ.
ຂັ້ນຕອນ (2). ການປ່ຽນຂອງ mevalonate ເປັນສອງ isoprene ທີ່ກະຕຸ້ນ. ໃນຂັ້ນຕອນຕໍ່ໄປຂອງການສັງເຄາະ cholesterol, ສາມກຸ່ມຟອສເຟດໄດ້ຖືກຍົກຍ້າຍຈາກໂມເລກຸນ ATP ໄປຫາ mevalonate (ຮູບ 21-35). ຟອສເຟດຜູກພັນກັບກຸ່ມໄຮໂດຼລິກທີ່ C-3 mevalonate ໃນລະດັບປານກາງ 3-phospho-5-pyrophosphomevalonate ແມ່ນກຸ່ມທີ່ປ່ອຍໃຫ້ດີ, ໃນຂັ້ນຕອນຕໍ່ໄປທັງສອງຂອງຟອສເຟດເຫຼົ່ານີ້ແລະກຸ່ມ carboxyl ທີ່ຢູ່ຕິດກັນ, ປະກອບເປັນພັນທະບັດສອງໃນຜະລິດຕະພັນກາກບອນ ∆ 3 -isopentenyl pyrophosphate. ນີ້ແມ່ນຄັ້ງທໍາອິດຂອງສອງ isoprenes ທີ່ຖືກກະຕຸ້ນ - ຜູ້ເຂົ້າຮ່ວມຕົ້ນຕໍໃນການສັງເຄາະ cholesterol. Isomerization ຂອງΔ 3 -isopentenylpyrophosphate ເຮັດໃຫ້ isoprene ເປີດໃຊ້ເປັນອັນດັບສອງ dimethylallyl pyrophosphate. ການສັງເຄາະ isopentenyl pyrophosphate ໃນ cytoplasm ຂອງຈຸລັງຂອງພືດເກີດຂື້ນຕາມເສັ້ນທາງທີ່ໄດ້ອະທິບາຍຢູ່ນີ້. ເຖິງຢ່າງໃດກໍ່ຕາມ, ພືດ chloroplasts ແລະເຊື້ອແບັກທີເຣັຍຫຼາຍຊະນິດໃຊ້ເສັ້ນທາງທີ່ບໍ່ມີສານ mevalonate. ເສັ້ນທາງເລືອກນີ້ບໍ່ພົບໃນສັດ, ສະນັ້ນມັນຈຶ່ງເປັນທີ່ດຶງດູດໃຈເມື່ອສ້າງຢາຕ້ານເຊື້ອ ໃໝ່.
ຊາວ. -3 21- .5. ການປ່ຽນໃຈເຫລື້ອມໃສຂອງ mevalonate ເຂົ້າໄປໃນຕັນ isoprene ທີ່ຖືກກະຕຸ້ນ. ຫົກ ໜ່ວຍ ທີ່ມີການເຄື່ອນໄຫວປະສົມປະສານກັນເພື່ອປະກອບເປັນ squalene (ເບິ່ງຮູບ 21-36). ກຸ່ມທີ່ອອກຈາກ 3-phospho-5-pyrophosphomevalonate ແມ່ນຖືກເນັ້ນເປັນສີບົວ. ໃນວົງເລັບມົນທົນແມ່ນສົມມຸດຖານລະດັບປານກາງ.

ຂັ້ນຕອນ (3). ສານລະລາຍຂອງຫົກ ໜ່ວຍ isoprene ທີ່ກະຕຸ້ນເພື່ອສ້າງເປັນ squalene. Isopentenyl pyrophosphate ແລະ dimethylallyl pyrophosphate ໃນປັດຈຸບັນ ກຳ ລັງຂົ້ນຫົວ - ຫາງ, ໃນນັ້ນກຸ່ມ pyrophosphate ໜຶ່ງ ເຄື່ອນໄຫວແລະຮູບແບບລະບົບຕ່ອງໂສ້ກາກບອນ 10 ຊະນິດ - geranyl pyrophosphate (ຮູບ 21-336). (Pyrophosphate ເອົາໃຈໃສ່ກັບຫົວ.) pyranph pyrophosphate ແມ່ນປະຕິບັດຕາມຂົ້ນຫົວກັບຫາງຕໍ່ໄປນີ້ກັບ isopentenyl pyrophosphate, ແລະຮູບແບບລະດັບປານກາງ 15 ກາກບອນ. farnesyl pyrophosphate. ສຸດທ້າຍ, ສອງໂມເລກຸນຂອງ pyrophosphate farnesyl ສົມທົບ“ ຫົວກັບຫົວ”, ທັງສອງກຸ່ມຟອສເຟດຖືກຍ້າຍອອກ - ສ້າງຕັ້ງຂື້ນ squalene.
ຊາວ. -3 21- .6. ການສ້າງແບບ Squalene. ໂຄງປະກອບ squalene ທີ່ມີປະລໍາມະນູກາກບອນ 30 ປະກົດຂື້ນໃນໄລຍະຂົ້ນສືບຕໍ່ກະຕຸ້ນໂດຍຕັນ isoprene (ຫ້າກາກບອນ).

ຊື່ສາມັນ ສຳ ລັບຕົວກາງເຫຼົ່ານີ້ແມ່ນມາຈາກຊື່ຂອງແຫຼ່ງຂໍ້ມູນທີ່ພວກເຂົາຖືກແຍກອອກເປັນຄັ້ງ ທຳ ອິດ. Geraniol, ສ່ວນປະກອບຂອງນ້ ຳ ມັນກຸຫລາບ, ມີລົດຊາດ geranium, ແລະ farnesol, ພົບໃນສີຂອງຕົ້ນກະຖິນ farnesa, ມີກິ່ນຫອມຂອງຮ່ອມພູທີ່ມີກິ່ນຫອມ. ມີກິ່ນ ເໝັນ ຈາກພືດຫລາຍຊະນິດເປັນຂອງສານປະກອບທີ່ສ້າງຂື້ນຈາກທ່ອນໄມ້ isoprene. Squalene, ແຍກອອກຈາກຕັບປາຊະນິດ ທຳ ອິດ (ຊະນິດ Squalus), ປະກອບດ້ວຍປະລໍາມະນູກາກບອນ 30 ຊະນິດ: ປະລໍາມະນູ 24 ຊະນິດໃນຕ່ອງໂສ້ຕົ້ນຕໍແລະຫົກປະລໍາມະນູໃນໂຕແທນໂລຫະ.
ຂັ້ນຕອນ (4). ການປ່ຽນແປງຂອງ squalene ເປັນສີ່ແຫວນຂອງແກນ steroid. ໃນຮູບ. 21-37 ມັນໄດ້ຖືກເຫັນຢ່າງຊັດເຈນວ່າໂຄງສ້າງລະບົບຕ່ອງໂສ້ squalene, ແລະ sterols - cyclic. ສານສະເຕີຣອຍທັງ ໝົດ ມີ 4 ແຫວນຂົ້ນທີ່ປະກອບເປັນແກນ steroid, ແລະທັງ ໝົດ ແມ່ນເຫຼົ້າທີ່ມີກຸ່ມ hydroxyl ຢູ່ C-3 atom, ເພາະສະນັ້ນ sterol ຊື່ພາສາອັງກິດ. ພາຍໃຕ້ການປະຕິບັດງານ squalene monooxygenase ປະລໍາມະນູອົກຊີເຈນຫນຶ່ງຈາກ O ຈະຖືກເພີ່ມເຂົ້າໃນຕອນທ້າຍຂອງລະບົບຕ່ອງໂສ້ squalene 2 ແລະ epoxide ໄດ້ຖືກສ້າງຕັ້ງຂຶ້ນ. ເອນໄຊນີ້ແມ່ນທາດອົກຊີແຊນອີກຢ່າງ ໜຶ່ງ ທີ່ມີ ໜ້າ ທີ່ປະສົມ (ເພີ່ມ. 21-1), NADPH ຫຼຸດຜ່ອນປະລໍາມະນູອົກຊີເຈນຈາກອໍ. 2 ເຖິງ H2 ອ. ສາຍຄູ່ຜະລິດຕະພັນ squalene-2,3-epoxide ຈັດລຽງເພື່ອໃຫ້ປະຕິກິລິຍາທີ່ມີຄວາມສອດຄ່ອງທີ່ ໜ້າ ສັງເກດສາມາດເຮັດໃຫ້ລະບົບຕ່ອງໂສ້ຂອງ squalene epoxide ກາຍເປັນໂຄງສ້າງຮອບວຽນ. ໃນຈຸລັງຂອງສັດ, ຮອບວຽນນີ້ ນຳ ໄປສູ່ lanosterol ເຊິ່ງປະກອບດ້ວຍສີ່ແຫວນລັກສະນະຂອງແກນ steroid. ດັ່ງນັ້ນ, lanosterol ຖືກປ່ຽນເປັນ cholesterol ໂດຍຜ່ານປະຕິກິລິຍາປະມານ 20 ຊະນິດເຊິ່ງປະກອບມີການເຄື່ອນຍ້າຍຂອງບາງກຸ່ມໂລຫະແລະການ ກຳ ຈັດຄົນອື່ນ. ລາຍລະອຽດຂອງເສັ້ນທາງຊີວະວິທະຍາທີ່ ໜ້າ ຕື່ນຕາຕື່ນໃຈນີ້, ໜຶ່ງ ໃນບັນດາຄວາມຫຍຸ້ງຍາກທີ່ສຸດໃນບັນດາຜູ້ທີ່ຮູ້ຈັກ, ໄດ້ຖືກສ້າງຂື້ນໂດຍ Conrad Bloch, Theodore Linen, John Cornfort ແລະ George Popiak ໃນທ້າຍຊຸມປີ 1950.
ຊາວ. -3 21- .7. ການປິດວົງແຫວນປ່ຽນສາຍ squalene ເສັ້ນເປັນຫຼັກ steroid ຂົ້ນ. ຂັ້ນຕອນ ທຳ ອິດແມ່ນຖືກກະຕຸ້ນໂດຍສານ oxidase ທີ່ມີ ໜ້າ ທີ່ປະສົມ (monooxygenase), ເຊິ່ງ cosubstrate ແມ່ນ N AD PH. ຜະລິດຕະພັນແມ່ນ epoxide, ເຊິ່ງໃນຂັ້ນຕອນຕໍ່ໄປວົງຈອນເພື່ອປະກອບເປັນແກນ steroid. ຜະລິດຕະພັນສຸດທ້າຍຂອງປະຕິກິລິຍາເຫຼົ່ານີ້ຢູ່ໃນຈຸລັງຂອງສັດແມ່ນ Cholesterol, ໃນອົງການຈັດຕັ້ງອື່ນໆ sterols ແຕກຕ່າງຈາກມັນຖືກສ້າງຕັ້ງຂື້ນ.


Cholesterol ແມ່ນຄຸນລັກສະນະ sterol ຂອງຈຸລັງສັດ, ພືດ, ເຫັດແລະ protists ຜະລິດ sterols ທີ່ຄ້າຍຄືກັນອື່ນໆ.
ພວກເຂົາໃຊ້ເສັ້ນທາງການສັງເຄາະແບບດຽວກັນກັບ squalene-2,3-epoxide, ແຕ່ວ່າຫຼັງຈາກນັ້ນເສັ້ນທາງຕ່າງໆກໍ່ຈະແຕກຕ່າງກັນເລັກນ້ອຍ, ແລະສານສະເຕີຣອຍອື່ນໆກໍ່ຖືກສ້າງຕັ້ງຂື້ນເຊັ່ນ: sigmasterol ໃນຫຼາຍໆພືດແລະ ergosterol ໃນເຊື້ອເຫັດ (ຮູບ 21-37).
ຕົວຢ່າງ 21-1 ຄ່າໃຊ້ຈ່າຍພະລັງງານ ສຳ ລັບການສັງເຄາະ Squalene
ຄ່າໃຊ້ຈ່າຍດ້ານພະລັງງານ (ສະແດງອອກເປັນໂມເລກຸນ ATP) ສຳ ລັບການສັງເຄາະໂມເລກຸນ squalene ໜຶ່ງ ໜ່ວຍ ແມ່ນຫຍັງ?
ວິທີແກ້ໄຂ. ໃນການສັງເຄາະຂອງ squalene ຈາກ acetyl-CoA, ATP ແມ່ນໃຊ້ເວລາພຽງແຕ່ໃນເວລາທີ່ mevalonate ຖືກປ່ຽນເປັນແຊນ squalene isoprene. ໂມເລກຸນ isoprene ທີ່ເປີດໃຊ້ງານ ຈຳ ນວນຫົກແມ່ນ ຈຳ ເປັນເພື່ອສ້າງໂມເລກຸນ squalene, ແລະໂມເລກຸນ ATP ຈຳ ນວນສາມແມ່ນ ຈຳ ເປັນເພື່ອຜະລິດໂມເລກຸນທີ່ເຄື່ອນໄຫວແຕ່ລະອັນ. ໃນຈໍານວນທັງຫມົດ, ໂມເລກຸນ 18 ATP ແມ່ນໃຊ້ຈ່າຍໃນການສັງເຄາະໂມເລກຸນ squalene ໜຶ່ງ ໜ່ວຍ.
ທາດປະສົມຂອງ cholesterol ໃນຮ່າງກາຍ
ໃນກະດູກສັນຫຼັງ, ປະລິມານຄໍເລດເຕີຣອນໃນຮ່າງກາຍຈະຖືກສັງເຄາະຢູ່ໃນຕັບ. ບາງສ່ວນຂອງຄໍເລສເຕີຣອນທີ່ຖືກສັງເຄາະຢູ່ນັ້ນໄດ້ຖືກລວມເຂົ້າໄປໃນເຍື່ອຂອງຕັບອັກເສບ hepatocytes, ແຕ່ມັນຖືກສົ່ງອອກເປັນສ່ວນໃຫຍ່ໃນ ໜຶ່ງ ໃນສາມຮູບແບບຂອງມັນ: ຄໍເລສເຕີຣອນ (ໄຂມັນ), ອາຊິດບີແລະກົດໄຂມັນໃນໄຂມັນ. ອາຊິດບີ ແລະເກືອຂອງພວກມັນແມ່ນເປັນອະນຸພັນຂອງຄໍເລສເຕີຣອນຂອງຄໍເລສເຕີຣອນເຊິ່ງຖືກສັງເຄາະຢູ່ໃນຕັບແລະປະກອບສ່ວນໃນການຍ່ອຍອາຫານຂອງໄຂມັນ (ເບິ່ງຮູບ 17-1). ປະລິມານ cholesterol ສ້າງຕັ້ງຂຶ້ນໃນຕັບໂດຍການປະຕິບັດ acyl-CoA-cholesterol-acyltransferase (ACAT). ທາດ enzyme ນີ້ຊ່ວຍກະຕຸ້ນການໂອນທາດໄຂມັນໄຂມັນຈາກ coenzyme A ໄປຫາກຸ່ມ hydroxyl ຂອງ cholesterol (ຮູບ 21-38), ປ່ຽນ cholesterol ເປັນຮູບແບບ hydrophobic ຫຼາຍ. Cholesterol esters ໃນສ່ວນປະກອບ lipoprotein ທີ່ລັບແມ່ນຖືກຂົນສົ່ງໄປຍັງເນື້ອເຍື່ອອື່ນໆໂດຍໃຊ້ cholesterol ຫຼືເກັບໄວ້ໃນຕັບ.
ຊາວ. -3 21- .8. ການສັງເຄາະຂອງ esters cholesterol. Etherification ເຮັດໃຫ້ cholesterol ເປັນຮູບແບບ hydrophobic ຫຼາຍກວ່າເກົ່າ ສຳ ລັບການເກັບຮັກສາແລະຂົນສົ່ງ.

Cholesterol ແມ່ນມີຄວາມ ຈຳ ເປັນ ສຳ ລັບເນື້ອເຍື່ອທັງ ໝົດ ຂອງອົງການລ້ຽງສັດທີ່ ກຳ ລັງເຕີບໃຫຍ່ເພື່ອການສັງເຄາະຂອງເຍື່ອ, ແລະບາງອະໄວຍະວະ (ຕົວຢ່າງ, ຕ່ອມ adrenal ແລະຕ່ອມເພດ ສຳ ພັນ) ໃຊ້ cholesterol ເປັນຕົວ ນຳ ກ່ອນຂອງຮໍໂມນສະເຕີຣອຍ (ນີ້ຈະໄດ້ຮັບການປຶກສາຫາລືລຸ່ມນີ້). Cholesterol ກໍ່ເປັນຕົວຢ່າງ ສຳ ຄັນຂອງວິຕາມິນ D (ເບິ່ງຮູບ 10-20, ໜ້າ 1).
Cholesterol ແລະ lipids ອື່ນໆມີ lipoproteins plasma
esters Cholesterol ແລະ cholesterol, ເຊັ່ນ triacylglycerols ແລະ phospholipids ແມ່ນປະຕິບັດບໍ່ລະລາຍໃນນ້ ຳ, ຢ່າງໃດກໍ່ຕາມ, ພວກມັນຕ້ອງຍ້າຍຈາກເນື້ອເຍື່ອທີ່ພວກມັນຖືກສັງເຄາະໄປຫາເນື້ອເຍື່ອບ່ອນທີ່ພວກມັນຈະຖືກເກັບມ້ຽນຫລືບໍລິໂພກ. ເຂົາເຈົ້າໄດ້ຖືກປະຕິບັດໂດຍເສັ້ນເລືອດໃນຮູບແບບຂອງ lipoproteins Plasma ເລືອດ - ສະລັບສັບຊ້ອນ macromolecular ຂອງທາດໂປຼຕີນຈາກການຂົນສົ່ງສະເພາະ (apolipoproteins) ມີ phospholipids, cholesterol, esters cholesterol ແລະ triacylglycerols ມີຢູ່ໃນສະລັບສັບຊ້ອນເຫຼົ່ານີ້ໃນການປະສົມຕ່າງໆ.
Apolipoproteins ("apo" ຫມາຍເຖິງທາດໂປຼຕີນທີ່ບໍ່ມີໄຂມັນໃນຕົວມັນເອງ) ປະສົມກັບ lipids ເພື່ອສ້າງສ່ວນປະກອບຂອງ lipoprotein ຫຼາຍໆສ່ວນ - ສະລັບສັບຊ້ອນ spherical ທີ່ມີ lipph hydrophobic ຢູ່ໃຈກາງແລະຕ່ອງໂສ້ອາຊິດ amino amino ຢູ່ເທິງພື້ນຜິວ (ຮູບ 21-39, a). ດ້ວຍການປະສົມປະສານຂອງ lipids ແລະທາດໂປຣຕີນຕ່າງໆ, ອະນຸພາກຂອງຄວາມ ໜາ ແໜ້ນ ທີ່ແຕກຕ່າງກັນແມ່ນສ້າງຕັ້ງຂື້ນ - ຈາກ chylomicrons ກັບ lipoproteins ທີ່ມີຄວາມ ໜາ ແໜ້ນ ສູງ. ອະນຸພາກເຫລົ່ານີ້ສາມາດແຍກອອກຈາກກັນໂດຍການຜະລິດແບບເລັ່ງລັດ (ຕາຕະລາງ 21-1) ແລະສັງເກດເຫັນໂດຍໃຊ້ກ້ອງຈຸລະທັດອິເລັກໂທຣນິກ (ຮູບ 21-39, b). ແຕ່ລະສ່ວນຂອງ lipoproteins ເຮັດ ໜ້າ ທີ່ສະເພາະ, ເຊິ່ງຖືກ ກຳ ນົດໂດຍສະຖານທີ່ຂອງການສັງເຄາະ, ສ່ວນປະກອບຂອງ lipid ແລະເນື້ອໃນຂອງ apolipoprotein. ຢ່າງຫນ້ອຍ 10 apolipoproteins ທີ່ແຕກຕ່າງກັນໄດ້ຖືກພົບເຫັນຢູ່ໃນ plasma ເລືອດຂອງມະນຸດ (ຕາຕະລາງ 21-2), ເຊິ່ງມີຂະ ໜາດ ແຕກຕ່າງກັນ, ປະຕິກິລິຍາກັບພູມຕ້ານທານສະເພາະແລະການແຈກຢາຍລັກສະນະໃນຊັ້ນ lipoproteins ທີ່ແຕກຕ່າງກັນ. ສ່ວນປະກອບຂອງທາດໂປຼຕີນເຫຼົ່ານີ້ເຮັດ ໜ້າ ທີ່ເປັນສານທີ່ເປັນສັນຍາລັກທີ່ ນຳ lipoproteins ໄປສູ່ເນື້ອເຍື່ອສະເພາະຫຼື enzymes ທີ່ກະຕຸ້ນທີ່ເຮັດ ໜ້າ ທີ່ໃນ lipoproteins.
ຕາຕະລາງ 21-1. lipoproteins plasma ຂອງມະນຸດ
ສ່ວນປະກອບ (ອັດຕາສ່ວນໃຫຍ່,%)
r = 513,000). ສ່ວນຂອງ LDL ບັນຈຸແກນຫຼັກຂອງທາດໂມເລກຸນ Cholesterol ປະມານ 1.500 ໂມ, ປະມານຫຼັກມີເປືອກໂມເລກຸນ 500 ໂມເລກຸນ, ໂປໂມຊຽມ phospholipids 800 ໂມເລກຸນແລະໂມເລກຸນ 1 ໜ່ວຍ ຂອງ apoB-100. b - lipoproteins 4 ຊັ້ນ, ສາມາດເບິ່ງເຫັນດ້ວຍກ້ອງຈຸລະທັດອິເລັກໂທຣນິກ (ຫຼັງຈາກການສະແດງຂອງລົບ). ຕາມເຂັມໂມງ, ເລີ່ມຕົ້ນຈາກຮູບເບື້ອງຊ້າຍດ້ານເທິງ: chylomicrons - ມີເສັ້ນຜ່າກາງ 50 ຫາ 200 nm, PL O NP - ຈາກ 28 ເຖິງ 70 nm, HDL - ຈາກ 8 ເຖິງ 11 nm, ແລະ LDL - ຈາກ 20 ເຖິງ 55 nm. ຄຸນສົມບັດຂອງ lipoproteins ແມ່ນໃຫ້ໃນຕາຕະລາງ. 21-2.

Chylomicrons, ອ້າງອີງເຖິງໃນ Sec. 17, ຍ້າຍອາຫານ triacylglycerols ຈາກລໍາໄສ້ໄປສູ່ເນື້ອເຍື່ອອື່ນໆ. ເຫຼົ່ານີ້ແມ່ນສານ lipoproteins ທີ່ໃຫຍ່ທີ່ສຸດ, ພວກມັນມີຄວາມ ໜາ ແໜ້ນ ຕ່ ຳ ທີ່ສຸດແລະມີເນື້ອຫາທີ່ກ່ຽວຂ້ອງສູງທີ່ສຸດຂອງ triacylglycerols (ເບິ່ງຮູບ 17-2). Chylomicrons ຖືກສັງເຄາະຢູ່ໃນ ER ຂອງຈຸລັງ epithelial ທີ່ຕິດຢູ່ໃນ ລຳ ໄສ້ນ້ອຍ, ຈາກນັ້ນເຄື່ອນຍ້າຍຜ່ານລະບົບ lymphatic ແລະເຂົ້າໄປໃນກະແສເລືອດໂດຍຜ່ານເສັ້ນເລືອດ subclavian ດ້ານຊ້າຍ. Chylomicron apolipoproteins ມີ apoB-48 (ເປັນເອກະລັກ ສຳ ລັບຊັ້ນ lipoproteins ນີ້), apoE ແລະ apoC-II (ຕາຕະລາງ 21-2). AroC-II ກະຕຸ້ນ lipoprotein lipase ໃນເສັ້ນໃຍຂອງເນື້ອເຍື່ອ adipose, ຫົວໃຈ, ກ້າມເນື້ອໂຄງກະດູກແລະຕ່ອມນົມທີ່ເປັນນົມ, ຮັບປະກັນການໄຫຼຂອງກົດໄຂມັນທີ່ບໍ່ເສຍຄ່າເຂົ້າໃນເນື້ອເຍື່ອເຫຼົ່ານີ້. ດັ່ງນັ້ນ, chylomicrons ໂອນອາຊິດໄຂມັນຂອງອາຫານໄປຫາເນື້ອເຍື່ອ, ເຊິ່ງມັນຈະຖືກບໍລິໂພກຫລືເກັບຮັກສາໄວ້ເປັນເຊື້ອໄຟ (ຮູບ 21-40). ສ່ວນທີ່ເຫຼືອຂອງ Chylomicron (ສ່ວນໃຫຍ່ແມ່ນຖືກປ່ອຍຈາກ triacylglycerols, ແຕ່ຍັງມີສານ cholesterol, apoE ແລະ apoB-48) ຖືກຂົນສົ່ງໂດຍກະແສເລືອດໄປສູ່ຕັບ. ໃນຕັບ, receptors ຜູກມັດກັບ apoE ທີ່ບັນຈຸຢູ່ໃນສານ chylomicron ແລະແກ້ໄຂການດູດຊຶມຂອງພວກມັນໂດຍ endocytosis. ໃນ hepatocytes, ສານເສດເຫຼືອເຫຼົ່ານີ້ຈະປ່ອຍ cholesterol ທີ່ພວກມັນບັນຈຸຢູ່ແລະຖືກ ທຳ ລາຍໃນໂລໂກ້.
ຕາຕະລາງ 21-2. lipoprotein ມະເລັງ plasma ຂອງມະນຸດ
ຟັງຊັນ (ຖ້າຮູ້)
ກະຕຸ້ນ L CAT, ພົວພັນກັບຜູ້ຂົນສົ່ງ ABC
Inhibits L CAT
ກະຕຸ້ນ L CAT, ການຂົນສົ່ງ / ລ້າງຄໍເລສເຕີຣອນ
ຜູກກັບຕົວຮັບ LDL
Chylomicrons, VLDL, HDL
Chylomicrons, VLDL, HDL
Chylomicrons, VLDL, HDL
ເລີ່ມຕົ້ນການເກັບກູ້ສິ່ງເສດເຫຼືອ VLDL ແລະ chylomicron
ໃນເວລາທີ່ອາຫານມີກົດໄຂມັນຫຼາຍກ່ວາມັນສາມາດຖືກນໍາໃຊ້ເປັນນໍ້າມັນເຊື້ອໄຟ, ພວກມັນປ່ຽນເປັນ triacylglycerols ໃນຕັບ, ເຊິ່ງປະກອບເປັນສ່ວນປະກອບທີ່ມີ apolipoproteins ສະເພາະ. lipoproteins ທີ່ມີຄວາມ ໜາ ແໜ້ນ ຕ່ ຳ ຫຼາຍ (VLDL). ທາດແປ້ງຫຼາຍເກີນໄປໃນຕັບຍັງສາມາດປ່ຽນເປັນ triacylglycerols ແລະສົ່ງອອກເປັນ VLDL (ຮູບ 21-40, a).ນອກເຫນືອໄປຈາກ triacylglycerols, ສ່ວນປະກອບ VLDL ມີຈໍານວນທີ່ແນ່ນອນຂອງ cholesterol ແລະ esters cholesterol, ເຊັ່ນດຽວກັນກັບ apoB-100, apoC-1, apoC-II, apoC III ແລະ apoE (ຕາຕະລາງ 21-2). lipoproteins ເຫຼົ່ານີ້ຍັງຖືກຂົນສົ່ງໂດຍເລືອດຈາກຕັບໄປຫາກ້າມເນື້ອແລະເນື້ອເຍື່ອ adipose, ບ່ອນທີ່, ຫຼັງຈາກ lipoprotein lipase ຖືກກະຕຸ້ນໂດຍ apo-C II, ກົດໄຂມັນຟຣີແມ່ນຖືກປ່ອຍອອກມາຈາກ triacylglycerols ຂອງສ່ວນປະກອບ VLDL. Adipocytes ເກັບອາຊິດໄຂມັນທີ່ບໍ່ເສຍຄ່າ, ອີກເທື່ອຫນຶ່ງປ່ຽນມັນເຂົ້າໄປໃນສານ triacylglycerols, ເຊິ່ງຖືກເກັບໄວ້ໃນຈຸລັງເຫຼົ່ານີ້ໃນຮູບແບບຂອງການລະລາຍໄຂມັນ (ຫຼຸດລົງ), myocytes, ໃນທາງກົງກັນຂ້າມ, ຜຸພັງອາຊິດໄຂມັນທັນທີເພື່ອຜະລິດພະລັງງານ. ສ່ວນທີ່ເຫຼືອຂອງ VLDL ແມ່ນຖືກລົບລ້າງຈາກການ ໝູນ ວຽນໂດຍ hepatocytes. ການດູດຊືມຂອງພວກມັນ, ຄ້າຍຄືກັບການດູດຊືມຂອງ chylomicrons, ຖືກໄກ່ເກ່ຍໂດຍຜູ້ຮັບແລະຂື້ນກັບການມີຂອງ apoE ໃນສານຕົກຄ້າງ VLDL (ໃນເພີ່ມ 21-2 ຄວາມ ສຳ ພັນລະຫວ່າງພະຍາດ apoE ແລະໂຣກ Alzheimer ໄດ້ຖືກອະທິບາຍ).
ຊາວ. 21-40. Lipoproteins ແລະ lipid ຂົນສົ່ງ, ແລະ - lipids ແມ່ນຂົນສົ່ງໂດຍກະແສເລືອດໃນຮູບແບບຂອງ lipoproteins, ເຊິ່ງປະສົມເຂົ້າໄປໃນສ່ວນປະກອບຫຼາຍໆຢ່າງທີ່ມີ ໜ້າ ທີ່ແຕກຕ່າງກັນແລະສ່ວນປະກອບທີ່ແຕກຕ່າງກັນຂອງທາດໂປຣຕີນແລະ lipids (tab. 21-1, 21-2) ແລະເທົ່າກັບຄວາມ ໜາ ແໜ້ນ ຂອງສ່ວນປະກອບເຫຼົ່ານີ້. lipids ອາຫານແມ່ນຮວບຮວມເຂົ້າໄປໃນ chylomicrons, ສ່ວນໃຫຍ່ຂອງ triacylglycerols ທີ່ບັນຈຸຢູ່ໃນພວກມັນຖືກປ່ອຍອອກມາໂດຍ lipoprotein lipase ເຂົ້າໄປໃນເນື້ອເຍື່ອ adipose ແລະກ້າມເນື້ອໃນ capillaries. ສານຕົກຄ້າງ Chylomicron (ປະກອບດ້ວຍທາດໂປຼຕີນແລະ cholesterol ສ່ວນໃຫຍ່) ແມ່ນຖືກຈັບໂດຍ hepatocytes. ໄຂມັນ lipogen ແລະ cholesterol ຈາກຕັບຖືກສົ່ງໄປຫາເນື້ອເຍື່ອ adipose ແລະກ້າມເນື້ອໃນຮູບແບບຂອງ VLDL. ການປ່ອຍທາດໄຂມັນຈາກ VLDL (ພ້ອມກັບການສູນເສຍຂອງຢາໂປໂມຊີນບາງຊະນິດ) ຄ່ອຍໆປ່ຽນ VLDLP ໄປເປັນ LDL, ເຊິ່ງສົ່ງສານຄໍເລສເຕີໂຣນໃຫ້ໄປຫາເນື້ອເຍື່ອພິເສດຫລືສົ່ງຄືນຕັບ. ຕັບຈະເກັບເອົາສິ່ງທີ່ເຫຼືອຂອງ VLDL, LDL ແລະສິ່ງທີ່ເຫຼືອຂອງ chylomicrons ໂດຍ endocytosis ຂອງ receptor-mediated. cholesterol ທີ່ເກີນໃນເນື້ອເຍື່ອ extrahepatic ຖືກຂົນສົ່ງກັບຄືນສູ່ຕັບໃນຮູບແບບຂອງ LDL. ໃນຕັບ, ສ່ວນ ໜຶ່ງ ຂອງຄໍເລສເຕີໂຣນປ່ຽນເປັນເກືອທີ່ເຮັດດ້ວຍເກືອ. b - ຕົວຢ່າງ plasma ເລືອດທີ່ປະຕິບັດຫຼັງຈາກຄວາມອຶດຫິວ (ເບື້ອງຊ້າຍ) ແລະຫຼັງຈາກກິນອາຫານທີ່ມີໄຂມັນສູງ (ເບື້ອງຂວາ). Chylomicrons ສ້າງຕັ້ງຂຶ້ນໂດຍການກິນອາຫານທີ່ມີໄຂມັນເຮັດໃຫ້ plasma ມີຄວາມຄ້າຍຄືກັບພາຍນອກກັບນົມ.

ດ້ວຍການສູນເສຍຂອງ triacylglycerols, ສ່ວນ ໜຶ່ງ ຂອງ VLDL ຖືກປ່ຽນເປັນທາດ VLDL, ຍັງເອີ້ນວ່າ lipoproteins ທີ່ມີຄວາມ ໜາ ແໜ້ນ ປານກາງ (VLDL), ການ ກຳ ຈັດ triacylglycerols ຕື່ມອີກຈາກ VLDL ໃຫ້ lipoproteins ຄວາມຫນາແຫນ້ນຕ່ໍາ (LDL) (tab. 21-1). ອັດຕາສ່ວນຂອງ LDL, ເຊິ່ງອຸດົມສົມບູນໃນ cholesterol ແລະ esters cholesterol, ແລະຍັງມີ apoB-100, ການໂອນໄຂມັນ cholesterol ໄປຫາເນື້ອເຍື່ອ extrahepatic ທີ່ມີຕົວຮັບສະເພາະຮັບຮູ້ apoB-100 ໃສ່ເຍື່ອ plasma. ເຄື່ອງຮັບເຫຼົ່ານີ້ຈະໄກ່ເກ່ຍການໃຊ້ສານ cholesterol ແລະ estrogen ໃນໄຂມັນ (ດັ່ງທີ່ອະທິບາຍຂ້າງລຸ່ມນີ້).
ເພີ່ມ 21-2.ApoE alleles ກຳ ນົດການເກີດຂອງພະຍາດ Alzheimer
ໃນ ຈຳ ນວນປະຊາກອນຂອງມະນຸດ, ມີສາມຕົວປ່ຽນແປງທີ່ຮູ້ຈັກ (ສາມລ້າໆ) ຂອງລະບົບສາຍພັນ gene apolipoprotein E. ຂອງ apelE alleles, APOEZ allele ແມ່ນພົບເຫັນຫຼາຍທີ່ສຸດໃນມະນຸດ (ປະມານ 78%), APOE4 ແລະ APOE2 alleles ແມ່ນ 15 ແລະ 7% ຕາມ ລຳ ດັບ. APOE4 allele ແມ່ນລັກສະນະພິເສດຂອງຄົນທີ່ເປັນໂຣກ Alzheimer, ແລະຄວາມ ສຳ ພັນນີ້ຊ່ວຍໃຫ້ການຄາດເດົາການເກີດຂື້ນຂອງພະຍາດມີຄວາມເປັນໄປໄດ້ສູງ. ຜູ້ທີ່ໄດ້ສືບທອດ APOE4 ມີຄວາມສ່ຽງສູງຕໍ່ການເປັນໂຣກ Alzheimer ໃນທ້າຍປີ. ຄົນທົ່ວໄປທີ່ບໍ່ມັກ ສຳ ລັບ APOE4 ແມ່ນມີຄວາມສ່ຽງຕໍ່ການພັດທະນາໂລກນີ້ເຖິງ 16 ເທົ່າ, ອາຍຸສະເລ່ຍຂອງຜູ້ທີ່ເຈັບເປັນແມ່ນມີອາຍຸປະມານ 70 ປີ. ສຳ ລັບຄົນທີ່ສືບທອດ AROEZ ສອງສະບັບ, ໃນທາງກົງກັນຂ້າມ, ອາຍຸສະເລ່ຍຂອງພະຍາດ Alzheimer ເກີນ 90 ປີ.
ພື້ນຖານໂມເລກຸນ ສຳ ລັບການເຊື່ອມໂຍງລະຫວ່າງ apoE4 ແລະພະຍາດ Alzheimer ແມ່ນຍັງບໍ່ທັນຮູ້ເທື່ອ. ນອກຈາກນັ້ນ, ມັນຍັງບໍ່ຈະແຈ້ງວ່າວິທີ apoE4 ສາມາດສົ່ງຜົນກະທົບຕໍ່ການຈະເລີນເຕີບໂຕຂອງສາຍແຮ່ amyloid, ເຊິ່ງປາກົດຂື້ນແມ່ນສາເຫດຕົ້ນຕໍຂອງພະຍາດ Alzheimer (ເບິ່ງຮູບ 4-31, v 1). ການສົມມຸດຕິຖານສຸມໃສ່ບົດບາດທີ່ເປັນໄປໄດ້ຂອງ apoE ໃນການຄົງຕົວໂຄງສ້າງຂອງ cytoskeleton ຂອງ neurons. ທາດໂປຼຕີນຈາກ apoE2 ແລະ apoEZ ຜູກພັນກັບທາດໂປຼຕີນຫຼາຍຢ່າງທີ່ກ່ຽວຂ້ອງກັບ microtubules ຂອງ neurons, ໃນຂະນະທີ່ apoE4 ບໍ່ຜູກມັດ. ນີ້ສາມາດເລັ່ງການເສຍຊີວິດຂອງ neurons. ບໍ່ວ່າກົນໄກນີ້ຈະເປັນໄປໄດ້ແນວໃດ, ການສັງເກດການເຫຼົ່ານີ້ກໍ່ໃຫ້ຄວາມຫວັງ ສຳ ລັບການຂະຫຍາຍຄວາມເຂົ້າໃຈຂອງພວກເຮົາກ່ຽວກັບ ໜ້າ ທີ່ທາງຊີວະວິທະຍາຂອງ apolipoproteins.
lipoproteins ປະເພດທີສີ່ - lipoproteins ທີ່ມີຄວາມ ໜາ ແໜ້ນ ສູງ (HDL), ສ່ວນປະກອບນີ້ແມ່ນສ້າງຂື້ນໃນຕັບແລະ ລຳ ໄສ້ນ້ອຍໃນຮູບແບບຂອງອະນຸພາກທາດໂປຼຕີນຂະ ໜາດ ນ້ອຍທີ່ບັນຈຸ cholesterol ທີ່ຂ້ອນຂ້າງ ໜ້ອຍ ແລະບໍ່ມີສານ estrogen ທີ່ເປັນໄຂມັນຢ່າງສົມບູນ (ຮູບ 21-40). ແຕ່ສ່ວນປະກອບ HDL ມີ apoA-I, apoC-I, apoC-II ແລະ apolipoproteins ອື່ນໆ (ຕາຕະລາງ 21-2), ເຊັ່ນດຽວກັນກັບ lecithin-cholesterol-acyltransferase (LC AT), ເຊິ່ງເປັນການກະຕຸ້ນການສ້າງຕັ້ງຂອງ esters cholesterol ຈາກ lecithin (phosphatidylcholine) ແລະ cholesterol (ຮູບ 21-41). L CAT ຢູ່ດ້ານຂອງອະນຸພາກ HDL ທີ່ຖືກສ້າງຕັ້ງຂື້ນ ໃໝ່ ປ່ຽນທາດ Chylomicron cholesterol ແລະ phosphatidylcholine ແລະ VLDL ເຂົ້າໄປໃນ esters cholesterol ເຊິ່ງເລີ່ມຕົ້ນປະກອບເປັນແກນ, ປ່ຽນອະນຸພາກ HDL ທີ່ຖືກສ້າງຕັ້ງຂື້ນມາ ໃໝ່ ເຂົ້າໄປໃນອະນຸພາກຂອງ HDL spherical. lipoprotein ທີ່ອຸດົມໄປດ້ວຍ cholesterol ນີ້ຈະຖືກສົ່ງກັບສູ່ຕັບ, ໃນເວລາທີ່ cholesterol ຈະຖືກ“ ປ່ອຍອອກ”, ບາງສ່ວນຂອງ cholesterol ນີ້ຈະຖືກປ່ຽນເປັນເກືອນໍ້າບີ.
ຊາວ. -4 21-1.. ປະຕິກິລິຍາທີ່ຖືກກະຕຸ້ນໂດຍ lecithin-cholesterol-acyltransferase (L CAT). ເອນໄຊນີ້ມີຢູ່ໃນ ໜ້າ ດິນຂອງອະນຸພາກ HDL ແລະຖືກກະຕຸ້ນໂດຍ apoA-1 (ສ່ວນປະກອບຂອງສ່ວນປະກອບ HDL). esters Cholesterol ສະສົມຢູ່ໃນອະນຸພາກ HDL ທີ່ສ້າງຂື້ນ ໃໝ່, ປ່ຽນເປັນ HDL ແກ່.

HDL ສາມາດຖືກດູດຊຶມເຂົ້າສູ່ຕັບໂດຍການຮັບເອົາໂຣກ endocytosis, ແຕ່ຢ່າງ ໜ້ອຍ ບາງສ່ວນຂອງໄຂມັນ HDL ຈະຖືກສົ່ງໄປຫາເນື້ອເຍື່ອອື່ນໆໂດຍກົນໄກອື່ນໆ. ອະນຸພາກ HDL ສາມາດຜູກພັນກັບ SR - ທາດໂປຼຕີນທີ່ຮັບເອົາ BI ໃນເຍື່ອຫຸ້ມຂອງ plasma ຂອງຈຸລັງຕັບແລະໃນເນື້ອເຍື່ອ steroid ເຊັ່ນ: ຕ່ອມ adrenal. ເຄື່ອງຮັບເຫຼົ່ານີ້ບໍ່ໄດ້ໄກ່ເກ່ຍພະຍາດ endocytosis, ແຕ່ວ່າການໂອນໄຂມັນສ່ວນ ໜຶ່ງ ແລະທາງເລືອກຂອງສ່ວນປະກອບ HDL ເຂົ້າໄປໃນຫ້ອງ. ແຕ່ສ່ວນປະກອບ HDL ທີ່ເຫຼືອ "ຫຼັງຈາກນັ້ນກໍ່ເຂົ້າໄປໃນກະແສເລືອດ, ບ່ອນທີ່ມັນປະກອບມີສ່ວນຂອງ lipids ໃໝ່ ຈາກ chylomicrons ແລະທາດ VLDL. HDL ດຽວກັນນີ້ຍັງສາມາດຈັບຕົວຄໍເລສເຕີໂຣນທີ່ເກັບໄວ້ໃນເນື້ອເຍື່ອພິເສດແລະຖ່າຍທອດໄປຫາຕັບໂດຍ ການຂົນສົ່ງໄຂມັນດ້ານຫຼັງ (ຮູບ 21-40). ໃນ ໜຶ່ງ ໃນຕົວປ່ຽນການຂົນສົ່ງແບບໂຕ້ຕອບ, ປະຕິ ສຳ ພັນຂອງ HDL ທີ່ໄດ້ຮັບກັບ SR-BI ໃນຈຸລັງທີ່ມີໄຂມັນໃນຄໍເລສເຕີໂຣນເລີ່ມຕົ້ນການແຜ່ກະຈາຍຂອງຄໍເລສເຕີຣອນທີ່ແຜ່ລາມຈາກ ໜ້າ ດິນໃຫ້ເປັນອະນຸພາກ HDL, ເຊິ່ງຈາກນັ້ນກໍ່ຈະໂອນຄໍເລດເຕີຣອນກັບຄືນສູ່ຕັບ. ໃນຕົວປ່ຽນແປງ ໃໝ່ ຂອງການຂົນສົ່ງດ້ານຫລັງໃນຫ້ອງຄໍເລດເຕີລອນທີ່ອຸດົມສົມບູນ, ຫຼັງຈາກການລ້າງສານ HDL, apoA-I ພົວພັນກັບຜູ້ສົ່ງຕໍ່ທີ່ເຄື່ອນໄຫວ, ທາດໂປຼຕີນຈາກ ABC. ApoA-I (ແລະ HDL ທີ່ສົມມຸດຕິຖານ) ແມ່ນຖືກດູດຊຶມໂດຍພະຍາດ endocytosis, ຫຼັງຈາກນັ້ນກໍ່ເຮັດຄວາມລັບອີກເທື່ອ ໜຶ່ງ, ບັນຈຸ cholesterol, ທີ່ຖືກຂົນສົ່ງໄປສູ່ຕັບ.
ທາດໂປຼຕີນຈາກ ABC1 ແມ່ນສ່ວນຫນຶ່ງຂອງຄອບຄົວທີ່ຂົນສົ່ງຢາເສບຕິດຫຼາຍ, ຜູ້ຂົນສົ່ງເຫຼົ່ານີ້ບາງຄັ້ງກໍ່ເອີ້ນວ່າຜູ້ຂົນສົ່ງ ABC, ເນື່ອງຈາກວ່າພວກມັນທັງ ໝົດ ມີຄາບຄາບ ATP-ຜູກມັດ (ATP - ສາຍຜູກມັດ), ພວກມັນຍັງມີສອງໂດເມນສົ່ງຕໍ່ພ້ອມດ້ວຍເຄື່ອງຊ່ວຍສົ່ງ transmembrane (ເບິ່ງ chap. . 11, v. 1). ທາດໂປຼຕີນເຫຼົ່ານີ້ໂອນເງິນຫຼາຍ ions, ອາຊິດ amino, ວິຕາມິນ, ຮໍໂມນ steroid ແລະເກືອນໍ້າບີຜ່ານເຍື່ອຫຸ້ມ plasma. ຜູ້ຕາງ ໜ້າ ຄົນອື່ນຂອງຄອບຄົວຜູ້ຂົນສົ່ງຄົນນີ້ແມ່ນໂປຣຕີນ CFTR, ເຊິ່ງມີໂຣກ fibrosis cystic, ໄດ້ຮັບຄວາມເສຍຫາຍ (ເບິ່ງເພີ່ມ 11-3, v. 1).
Cholesterol esters ເຂົ້າໄປໃນຈຸລັງໂດຍຜ່ານໂຣກ endocytosis ຂອງ receptor-mediated
ແຕ່ລະສ່ວນຂອງອະນຸພາກ LDL ໃນກະແສເລືອດມີ apoB-100, ເຊິ່ງຖືກຮັບຮູ້ໂດຍໂປຣຕີນທີ່ຮັບສະເພາະດ້ານ -ເຄື່ອງຮັບ LDL ກ່ຽວກັບເຍື່ອຂອງຈຸລັງທີ່ຈໍາເປັນຕ້ອງໄດ້ເກັບກໍາ cholesterol. ການຜູກພັນຂອງ LDL ກັບ LDL receptor ເລີ່ມຕົ້ນ endocytosis, ຍ້ອນວ່າ LDL ແລະຕົວຮັບຂອງມັນເຄື່ອນຍ້າຍເຂົ້າໄປໃນຫ້ອງທີ່ຢູ່ໃນທີ່ສຸດ (ຮູບ 21-42). ໃນທີ່ສຸດຄວາມອົດທົນປະສົມກັບ lysosome, ເຊິ່ງມີ enzymes ທີ່ hydrolyze esters cholesterol, ປ່ອຍ cholesterol ແລະກົດໄຂມັນເຂົ້າໄປໃນ cytosol. ApoB-100 ຈາກ LDL ຍັງແຍກເພື່ອສ້າງເປັນກົດອະມິໂນທີ່ຖືກປິດລັບໃນ cytosol, ແຕ່ຕົວຮັບ LDL ຈະຫລີກລ້ຽງການເສື່ອມສະພາບແລະກັບມາສູ່ພື້ນຜິວຂອງຈຸລັງເພື່ອເຂົ້າຮ່ວມອີກຄັ້ງໃນການດູດຊືມ LDL. ApoB-100 ຍັງມີຢູ່ໃນ VLDL, ແຕ່ວ່າໂດເມນທີ່ມີຂໍ້ຜູກມັດຂອງມັນບໍ່ສາມາດຜູກມັດກັບ LDL receptor ໄດ້; ການປ່ຽນ VLDLP ກັບ LDL ເຮັດໃຫ້ໂດເມນທີ່ຜູກມັດ receptor ເຂົ້າໄປໃນ apoB-100 ສາມາດເຂົ້າເຖິງໄດ້. ເສັ້ນທາງຂົນສົ່ງໃນເລືອດນີ້ແລະເສັ້ນໂລຫິດແດງ endocytosis ທີ່ໄດ້ຮັບສານໃນແພຈຸລັງເປົ້າ ໝາຍ ໄດ້ຖືກສຶກສາໂດຍ Michael Brown ແລະ Joseph Goldstein.
Michael Brown ແລະ Joseph Goldstein

ຊາວ. 21-42. ການຈັບຕົວຂອງຄໍເລສເຕີຣອນໂດຍການຮັບເອົາສານ endocytosis.

Cholesterol, ເຊິ່ງເຂົ້າສູ່ຈຸລັງໃນທາງນີ້, ສາມາດຖືກລວມເຂົ້າເປັນເຍື່ອຫຼືເປັນການຢັ້ງຢືນຄືນ ໃໝ່ ໂດຍ ACAT (ຮູບ 21-38) ສຳ ລັບເກັບຮັກສາໄວ້ໃນ cytosol ພາຍໃນ droplets lipid. ໃນເວລາທີ່ມີຄໍເລດເຕີລໍພຽງພໍທີ່ມີຢູ່ໃນສ່ວນຂອງເລືອດ LDL, ການສະສົມຂອງທາດໄຂມັນສ່ວນເກີນຈະຖືກປ້ອງກັນໂດຍການຫຼຸດຜ່ອນອັດຕາການສັງເຄາະຂອງມັນ.
ຕົວຮັບ LDL ຍັງຕິດກັບ apoE ແລະມີບົດບາດ ສຳ ຄັນໃນການຮັບສານ chylomicrons ແລະ VLDL ທີ່ຕົກຄ້າງໂດຍຕັບ. ເຖິງຢ່າງໃດກໍ່ຕາມ, ຖ້າ receptors LDL ບໍ່ສາມາດໃຊ້ໄດ້ (ເຊັ່ນ, ໃນສາຍຫນູທີ່ມີ gene LDL receptor ທີ່ຂາດຫາຍໄປ), ສານ VLDL ແລະທາດ chylomicrons ຍັງຖືກດູດຊືມຈາກຕັບ, ເຖິງແມ່ນວ່າ LDL ບໍ່ດູດຊຶມ. ນີ້ສະແດງເຖິງການມີລະບົບສະຫງວນ ສຳ ລັບໂຣກ endocytosis ທີ່ໄດ້ຮັບການໄກ່ເກ່ຍຂອງສານ VLDL ແລະທາດ chylomicron. ໜຶ່ງ ໃນບັນດາຜູ້ສະຫງວນແມ່ນທາດໂປຼຕີນ LRP (ທາດໂປຼຕີນທີ່ໄດ້ຮັບສານ lipoprotein - ທາດໂປຼຕີນທີ່ກ່ຽວຂ້ອງ), ເຊິ່ງພົວພັນກັບ receptors lipoprotein, ເຊິ່ງຜູກກັບ apoE ແລະເສັ້ນໄຍອື່ນໆ.
ລະດັບຫຼາຍຂອງລະບຽບການ biosynthesis cholesterol
ການສັງເຄາະ Cholesterol ແມ່ນຂະບວນການທີ່ຊັບຊ້ອນແລະມີລາຄາແພງ, ສະນັ້ນມັນຈະແຈ້ງວ່າຮ່າງກາຍໄດ້ຮັບຜົນປະໂຫຍດທີ່ຈະມີກົນໄກໃນການຄວບຄຸມ biosynthesis cholesterol ເຊິ່ງເຮັດໃຫ້ປະລິມານຂອງມັນເພີ່ມປະລິມານບວກກັບສິ່ງທີ່ມາກັບອາຫານ. ໃນສັດລ້ຽງລູກດ້ວຍນ້ ຳ ນົມ, ການຜະລິດຄໍເລສເຕີຣອນແມ່ນຖືກຄວບຄຸມດ້ວຍຄວາມເຂັ້ມຂົ້ນຂອງ intracellular
cholesterol ແລະຮໍໂມນ glucagon ແລະ insulin. ຂັ້ນຕອນຂອງການປ່ຽນ HMG - CoA ກັບ mevalonate (ຮູບ 21-34) ຈຳ ກັດຄວາມໄວໃນເສັ້ນທາງການເຜົາຜະຫລານຂອງການສ້າງຄໍເລດເຕີຣອນ (ຈຸດຕົ້ນຕໍຂອງລະບຽບ). ປະຕິກິລິຍານີ້ແມ່ນຖືກລະບາຍໂດຍ HMG - CoA reductase. ກົດລະບຽບໃນການຕອບສະ ໜອງ ຕໍ່ການປ່ຽນແປງຂອງລະດັບຄໍເລດເຕີລອນແມ່ນຖືກໄກ່ເກ່ຍໂດຍລະບົບການໂອນຂໍ້ມູນທີ່ສະຫງ່າງາມ ສຳ ລັບການລະຫັດພັນທຸ ກຳ HMG - CoA reductase. ພັນທຸ ກຳ ນີ້ຮ່ວມກັບຫຼາຍກວ່າ 20 ຊະນິດທີ່ເຂົ້າລະບົບພັນທຸ ກຳ ທີ່ມີສ່ວນຮ່ວມໃນການດູດຊຶມແລະການສັງເຄາະທາດໄຂມັນແລະກົດໄຂມັນທີ່ບໍ່ສົມດຸນ, ຄວບຄຸມໂດຍຄອບຄົວໂປຣຕີນນ້ອຍໆທີ່ເອີ້ນວ່າໂປຣຕີນທີ່ພົວພັນກັບອົງປະກອບກົດລະບຽບຂອງການສ້າງທາດໂປຼຕີນ (SREBP, ທາດໂປຼຕີນທີ່ຜູກມັດທາດໂປຼຕີນຈາກທາດໂປຼຕີນ). . ຫຼັງຈາກການສັງເຄາະ, ທາດໂປຼຕີນເຫຼົ່ານີ້ຖືກນໍາສະເຫນີເຂົ້າໃນ reticulum endoplasmic. ໂດເມນ SREBP ທີ່ສາມາດລະລາຍໄດ້ພຽງແຕ່ປະຕິບັດ ໜ້າ ທີ່ເປັນເຄື່ອງກະຕຸ້ນການໂອນຍ້າຍໂດຍໃຊ້ກົນໄກຕ່າງໆທີ່ອະທິບາຍໄວ້ໃນ Ch. 28 (v. 3). ເຖິງຢ່າງໃດກໍ່ຕາມ, ໂດເມນນີ້ບໍ່ສາມາດເຂົ້າເຖິງແກນແລະບໍ່ສາມາດເຂົ້າຮ່ວມໃນການກະຕຸ້ນຂອງ gene ໄດ້ຕາບໃດທີ່ມັນຍັງຄົງຢູ່ໃນໂມເລກຸນ SREBP. ເພື່ອກະຕຸ້ນການໂອນຍ້າຍຂອງ gene HMG - CoA reductase ແລະພັນທຸ ກຳ ອື່ນໆ, ໂດເມນທີ່ເຄື່ອນໄຫວໃນການໂອນຍ້າຍແມ່ນແຍກອອກຈາກສ່ວນທີ່ເຫຼືອຂອງ SREBP ໂດຍການປ້ອງກັນຂອງ proteolytic. ເມື່ອຄໍເລດເຕີຣອນສູງ, ທາດໂປຼຕີນ SREBP ບໍ່ມີປະສິດຕິພາບ, ຖືກແກ້ໄຂດ້ວຍທາດ ER ໃນສະລັບສັບຊ້ອນທີ່ມີທາດໂປຼຕີນອື່ນທີ່ເອີ້ນວ່າ SCAP (SREBP - ທາດໂປຼຕີນຈາກການໃຊ້ສານສະກັດກັ້ນ) (ຮູບ 21-43). ມັນແມ່ນ SCAP ທີ່ຜູກຄໍເລສເຕີຣອນແລະສານສະເຕີຣອຍອີກ ຈຳ ນວນ ໜຶ່ງ, ເຮັດ ໜ້າ ທີ່ເປັນເຊັນເຊີສະເຕີຣອຍ. ເມື່ອລະດັບ sterol ສູງ, ສະລັບສັບຊ້ອນ SCAP - SREBP ອາດຈະພົວພັນກັບທາດໂປຼຕີນອື່ນ, ເຊິ່ງເຮັດໃຫ້ສະລັບສັບຊ້ອນທັງ ໝົດ ໃນ ER. ໃນເວລາທີ່ລະດັບຂອງ sterols ໃນຫ້ອງຫຼຸດລົງ, ການປ່ຽນແປງທີ່ສອດຄ່ອງໃນ SCAP ນໍາໄປສູ່ການສູນເສຍກິດຈະກໍາການຮັກສາໄວ້, ແລະສະລັບສັບຊ້ອນ SCAP - SREBP ເຄື່ອນຍ້າຍພາຍໃນ vesicles ໄປສູ່ສະລັບສັບຊ້ອນ Golgi. ໃນສະລັບສັບຊ້ອນ Golgi, ທາດໂປຼຕີນຈາກ SREBP ຖືກກີດກັນສອງຄັ້ງໂດຍສອງທາດໂປຼຕີນທີ່ແຕກຕ່າງກັນ, ການແຊກແຊງຄັ້ງທີສອງປ່ອຍໂດເມນ amino-terminal ເຂົ້າໄປໃນ cytosol. ໂດເມນນີ້ຍ້າຍໄປຢູ່ໃນແກນແລະກະຕຸ້ນການໂອນຍ້າຍຂອງເຊື້ອສາຍເປົ້າຫມາຍ. ໂດເມນທາດໂປຼຕີນຈາກ SREBP ຂອງ amino-terminal ມີອາຍຸການໃຊ້ງານສັ້ນເຄິ່ງ ໜຶ່ງ ແລະຖືກ ທຳ ລາຍໂດຍ proteasomes ຢ່າງໄວວາ (ເບິ່ງຮູບ 27-48, t. 3). ໃນເວລາທີ່ລະດັບຂອງ sterol ເພີ່ມຂື້ນຢ່າງພຽງພໍ, ການປ່ອຍ proteolytic ຂອງໂດເມນທາດໂປຼຕີນຈາກ SR EBP ກັບ amino amino terminus ໄດ້ຖືກສະກັດອີກເທື່ອຫນຶ່ງ, ແລະການເຊື່ອມໂຊມຂອງ proteasome ຂອງໂດເມນທີ່ມີການເຄື່ອນໄຫວທີ່ມີຢູ່ແລ້ວເຮັດໃຫ້ການປິດຂອງເຊື້ອສາຍເປົ້າຫມາຍ.
ຊາວ. -4 21- .3. ການກະຕຸ້ນຂອງ SR EBP. ທາດໂປຼຕີນຈາກ SREB P ໂຕ້ຕອບກັບອົງປະກອບທີ່ມີກົດລະບຽບ sterol (ສີຂຽວ), ທັນທີຫຼັງຈາກການສັງເຄາະ, ຖືກ ນຳ ເຂົ້າໄປໃນຍຸກ ER, ປະກອບເປັນສະລັບສັບຊ້ອນກັບ S CAP (ສີແດງ). (N ແລະ C ໝາຍ ເຖິງທາດ amine ແລະ carboxyl ທີ່ສຸດຂອງທາດໂປຼຕີນ.) ໃນສະຖານະການ S-CAP, ທາດໂປຼຕີນ SRE BP ແມ່ນບໍ່ມີປະໂຫຍດ. ໃນເວລາທີ່ລະດັບ sterol ຫຼຸດລົງ, ສະລັບສັບຊ້ອນ SR EBP-S CAP ເຄື່ອນຍ້າຍໄປສູ່ສະລັບສັບຊ້ອນ Golgi, ແລະທາດໂປຼຕີນຈາກ SR EBP ຖືກຈັດລຽງຕາມ ລຳ ດັບໂດຍສອງທາດທີ່ແຕກຕ່າງກັນ. ໂດເມນທາດໂປຼຕີນຈາກທາດໂປຼຕີນຈາກທາດໂປຼຕີນ amino ທີ່ຖືກເປີດເສລີທາງການເຄື່ອນຍ້າຍໄປສູ່ແກນ, ບ່ອນທີ່ມັນກະຕຸ້ນການໂອນຍ້າຍຂອງເຊື້ອໂຣກທີ່ຄວບຄຸມໂດຍ sterol.

ການສັງເຄາະ Cholesterol ແມ່ນຖືກຄວບຄຸມໂດຍກົນໄກອື່ນອີກ (ຮູບ 21-44). ການຄວບຄຸມຮໍໂມນແມ່ນການໄກ່ເກ່ຍໂດຍການດັດແກ້ covalent ຂອງ NM G-CoA reductase. ເອນໄຊນີ້ມີຢູ່ໃນຮູບແບບ phosphorylated (ບໍ່ມີການເຄື່ອນໄຫວ) ແລະ dephosphorylated (ມີການເຄື່ອນໄຫວ). Glucagon ຊ່ວຍກະຕຸ້ນການ phosphorylation (inactivation) ຂອງ enzyme, ແລະ insulin ສົ່ງເສີມ dephosphorylation, ກະຕຸ້ນເອນໄຊແລະມັກການສັງເຄາະຂອງ cholesterol. ຄວາມເຂັ້ມຂົ້ນຂອງໄຂມັນໃນລະດັບສູງເຮັດໃຫ້ ASAT ກະຕຸ້ນການເພີ່ມຂື້ນຂອງ esterification ຂອງ cholesterol ສຳ ລັບການຝາກເງິນ. ສຸດທ້າຍ, ລະດັບ cholesterol ໃນລະດັບສູງຍັບຍັ້ງການສົ່ງຕໍ່ຂອງ gene ທີ່ເຂົ້າລະບົບຕົວຮັບ LDL, ຫຼຸດການຜະລິດຂອງ receptor ນີ້ແລະເພາະສະນັ້ນ, ການດູດເອົາ cholesterol ຈາກເລືອດ.
ຊາວ. 21-44. ການຄວບຄຸມລະດັບ cholesterol ຈະຊ່ວຍໃຫ້ມີຄວາມສົມດຸນລະຫວ່າງການສັງເຄາະແລະການດູດຊຶມຂອງ cholesterol ຈາກອາຫານ. Glucagon ຊ່ວຍໃຫ້ phosphorylation (inactivation) ຂອງ NM G -CoA reductase, insulin ສົ່ງເສີມການ dephosphorylation (ການກະຕຸ້ນ). X - ທາດແປ້ງໄຂມັນທີ່ບໍ່ໄດ້ລະບຸຊື່ວ່າກະຕຸ້ນການຜະລິດທາດໂປຼຕີນຈາກ NM G -CoA reductase.

cholesterol ທີ່ບໍ່ຄວບຄຸມສາມາດນໍາໄປສູ່ການເປັນໂຣກຮ້າຍແຮງໃນມະນຸດ. ໃນເວລາທີ່ປະລິມານທັງ ໝົດ ຂອງຄໍເລສເຕີຣອນແລະຄໍເລສເຕີຣອນທີ່ໄດ້ຮັບຈາກອາຫານເກີນ ຈຳ ນວນທີ່ ຈຳ ເປັນ ສຳ ລັບການປະກອບຂອງເຍື່ອ, ການສັງເຄາະຂອງນ້ ຳ ເກືອແລະສານສະເຕີຣອຍ, ການສະສົມຂອງເສັ້ນເລືອດໃນຄໍເລສເຕີໂຣນໃນເສັ້ນເລືອດ (plaques atherosclerotic) ອາດຈະປາກົດ, ເຮັດໃຫ້ການອຸດຕັນຂອງພວກມັນ (atherosclerosis). ໃນບັນດາປະເທດອຸດສາຫະ ກຳ, ມັນແມ່ນຄວາມລົ້ມເຫຼວຂອງຫົວໃຈຍ້ອນການອຸດຕັນຂອງເສັ້ນເລືອດແດງທີ່ເປັນສາເຫດຕົ້ນຕໍຂອງການຕາຍ. ການພັດທະນາຂອງໂຣກ atherosclerosis ແມ່ນກ່ຽວຂ້ອງກັບລະດັບໄຂມັນໃນລະດັບສູງແລະໂດຍສະເພາະກັບ cholesterol ທີ່ຍອມຮັບໄດ້ຈາກສ່ວນປະກອບຂອງ LDL;
ມີ hypercholesterolemia ທີ່ມີເຊື້ອໄວຣັດ (ເປັນໂຣກຜິດປົກກະຕິທາງພັນທຸກໍາ), ລະດັບຂອງໄຂມັນໃນເລືອດແມ່ນສູງຫຼາຍ - ໂຣກ atherosclerosis ຮ້າຍແຮງພັດທະນາໃນຄົນເຫຼົ່ານີ້ຢູ່ໃນໄວເດັກ. ເນື່ອງຈາກຕົວຮັບ LDL ທີ່ຂາດຕົກບົກຜ່ອງ, ການດູດເອົາສານ LDL Cholesterol- receptor-mediated ບໍ່ພຽງພໍເກີດຂື້ນ. ດ້ວຍເຫດນັ້ນ, ຄໍເລສເຕີໂຣນບໍ່ໄດ້ຖືກເອົາອອກຈາກກະແສເລືອດ, ມັນຈະສະສົມແລະປະກອບສ່ວນເຂົ້າໃນການສ້າງແຜ່ນຂອງ atherosclerotic. ການສັງເຄາະຂອງໄຂມັນທີ່ເຮັດໃຫ້ເກີດຂື້ນຍັງສືບຕໍ່, ເຖິງແມ່ນວ່າຈະມີໄຂມັນສ່ວນເກີນໃນເລືອດ, ເນື່ອງຈາກວ່າຄໍເລດເຕີຣອນເສີມຈະບໍ່ສາມາດເຂົ້າໄປໃນຫ້ອງເພື່ອຄວບຄຸມການສັງເຄາະ intracellular (ຮູບ 21-444).ສຳ ລັບການປິ່ນປົວຄົນເຈັບທີ່ມີໂຣກ hypercholesterolemia ທີ່ມີເຊື້ອໄວຣັດແລະພະຍາດອື່ນໆທີ່ກ່ຽວຂ້ອງກັບລະດັບ cholesterol serum ສູງຂື້ນ, ຫ້ອງຮຽນ statin ແມ່ນໃຊ້. ບາງສ່ວນຂອງພວກມັນແມ່ນໄດ້ມາຈາກແຫລ່ງ ທຳ ມະຊາດ, ໃນຂະນະທີ່ຜະລິດຕະພັນອື່ນໆແມ່ນສັງເຄາະໂດຍອຸດສາຫະ ກຳ ການຢາ. Statins ແມ່ນຄ້າຍຄືກັບ mevalonate (ເພີ່ມ. 21-3) ແລະເປັນຕົວຍັບຍັ້ງການແຂ່ງຂັນຂອງ NMS-CoA reductase.
ເພີ່ມ 21-3. ຢາ MEDICINE. ສົມມຸດຕິຖານ lipid ແລະການສ້າງ statins
ພະຍາດຫົວໃຈຫຼອດເລືອດຫົວໃຈ (CHD) ແມ່ນສາເຫດຕົ້ນຕໍຂອງການເສຍຊີວິດໃນປະເທດທີ່ພັດທະນາແລ້ວ. ເສັ້ນເລືອດແດງແຄບທີ່ເຮັດໃຫ້ເລືອດໄປສູ່ຫົວໃຈເກີດຂື້ນເນື່ອງຈາກການປະກອບຂອງເງິນຝາກໄຂມັນທີ່ເອີ້ນວ່າແຜ່ນ atherosclerotic, ແຜ່ນເຫຼົ່ານີ້ບັນຈຸ cholesterol, ທາດໂປຣຕີນ fibrillar, calcium, platelet, ແລະຊິ້ນສ່ວນຂອງຈຸລັງ. ໃນສະຕະວັດທີ XX. ມີການໂຕ້ວາທີຢ່າງຫ້າວຫັນກ່ຽວກັບຄວາມ ສຳ ພັນລະຫວ່າງການອຸດຕັນຂອງເສັ້ນເລືອດແດງ (atherosclerosis) ແລະ cholesterol ໃນເລືອດ. ການສົນທະນາເຫຼົ່ານີ້ແລະການຄົ້ນຄ້ວາຢ່າງຫ້າວຫັນໃນທິດທາງນີ້ໄດ້ເຮັດໃຫ້ມີການສ້າງຢາທີ່ມີປະສິດຕິຜົນທີ່ເຮັດໃຫ້ຄໍເລສເຕີຣອນຫຼຸດລົງ.
ໃນປີ 1913, N.N. Anichkov, ນັກວິທະຍາສາດແລະຊ່ຽວຊານດ້ານວິທະຍາສາດດ້ານພາສາລັດເຊຍທີ່ມີຊື່ສຽງ, ໄດ້ເຜີຍແຜ່ຜົນງານທີ່ລາວໄດ້ສະແດງໃຫ້ເຫັນວ່າກະຕ່າຍທີ່ລ້ຽງດ້ວຍອາຫານທີ່ມີຄໍເລດເຕີຣອນພັດທະນາຄວາມເສຍຫາຍຕໍ່ເສັ້ນເລືອດທີ່ຄ້າຍຄືກັບແຜ່ນ atherosclerotic ໃນເຮືອຂອງຜູ້ສູງອາຍຸ. Anichkov ໄດ້ເຮັດການຄົ້ນຄວ້າຂອງລາວເປັນເວລາຫລາຍທົດສະວັດແລະໄດ້ເຜີຍແຜ່ຜົນໄດ້ຮັບໃນວາລະສານຕາເວັນຕົກທີ່ມີຊື່ສຽງ. ແຕ່ໂຊກບໍ່ດີ, ຂໍ້ມູນຂອງລາວບໍ່ໄດ້ກາຍເປັນພື້ນຖານຂອງຕົວແບບ ສຳ ລັບການພັດທະນາໂຣກ atherosclerosis ໃນມະນຸດ, ເນື່ອງຈາກວ່າໃນເວລານັ້ນສົມມຸດຕິຖານແມ່ນວ່າພະຍາດນີ້ເປັນຜົນມາຈາກ ທຳ ມະຊາດຂອງຄວາມເຖົ້າແລະບໍ່ສາມາດປ້ອງກັນໄດ້. ເຖິງຢ່າງໃດກໍ່ຕາມ, ຫຼັກຖານໄດ້ຄ່ອຍໆສະສົມຄວາມ ສຳ ພັນລະຫວ່າງຄໍເລສເຕີໂຣນແລະການພັດທະນາຂອງໂລກ atherosclerosis (lipid hypothesis), ແລະໃນຊຸມປີ 1960. ນັກຄົ້ນຄວ້າບາງຄົນໄດ້ກ່າວຢ່າງຈະແຈ້ງວ່າພະຍາດນີ້ສາມາດປິ່ນປົວໄດ້ດ້ວຍຢາປິ່ນປົວ. ເຖິງຢ່າງໃດກໍ່ຕາມ, ທັດສະນະທີ່ກົງກັນຂ້າມມີຢູ່ຈົນຮອດການພິມເຜີຍແຜ່ໃນປີ 1984 ຂອງຜົນຂອງການສຶກສາຢ່າງກວ້າງຂວາງກ່ຽວກັບບົດບາດຂອງໄຂມັນທີ່ເຮັດໂດຍສະຖາບັນສຸຂະພາບແຫ່ງຊາດຂອງສະຫະລັດອາເມລິກາ (ການທົດລອງປ້ອງກັນພະຍາດເບື້ອງຕົ້ນ). ສະແດງໃຫ້ເຫັນການຫຼຸດລົງຢ່າງຫຼວງຫຼາຍຂອງຄວາມຖີ່ຂອງການອັກເສບ myocardial infarction ແລະເສັ້ນເລືອດຕັນໃນດ້ວຍການຫຼຸດລົງຂອງ cholesterol ໃນເລືອດໄດ້ຖືກສະແດງໃຫ້ເຫັນ. ໃນການສຶກສາຄັ້ງນີ້, ໜິ້ວ cholesterol, ສານແລກປ່ຽນນ້ ຳ ໜັກ anion ທີ່ຜູກກັບກົດອາຊິດບີໄດ້ຖືກ ນຳ ໃຊ້ເພື່ອຫຼຸດລະດັບ cholesterol. ຜົນໄດ້ຮັບໄດ້ກະຕຸ້ນການຊອກຫາຢາປິ່ນປົວ ໃໝ່ ທີ່ມີປະສິດຕິພາບສູງກວ່າເກົ່າ. ຂ້າພະເຈົ້າຕ້ອງເວົ້າວ່າໃນໂລກວິທະຍາສາດ, ຄວາມສົງໄສກ່ຽວກັບຄວາມຖືກຕ້ອງຂອງການສົມມຸດຕິຖານຂອງ lipid ຫາຍໄປຫມົດພຽງແຕ່ກັບການມາເຖິງຂອງ statins ໃນທ້າຍຊຸມປີ 1980 - ຕົ້ນຊຸມປີ 1990.
ສະຖິຕິ ທຳ ອິດຖືກຄົ້ນພົບໂດຍ Akira Endo ທີ່ Sankyo ໃນໂຕກຽວ. Endo ໄດ້ເຜີຍແຜ່ຜົນງານຂອງລາວໃນປີ 1976, ເຖິງແມ່ນວ່າລາວໄດ້ຈັດການກັບບັນຫາຂອງການເຜົາຜານໄຂມັນໃນຄໍເລສເຕີໂຣນເປັນເວລາຫລາຍປີ. ໃນປີ 1971, ທ່ານໄດ້ແນະ ນຳ ວ່າຕົວຍັບຍັ້ງການສັງເຄາະ cholesterol ອາດຈະມີຢູ່ໃນຜູ້ຜະລິດເຫັດຂອງຢາຕ້ານເຊື້ອທີ່ໄດ້ສຶກສາໃນເວລານັ້ນ. ເປັນເວລາຫລາຍປີທີ່ໄດ້ເຮັດວຽກຢ່າງເຂັ້ມຂົ້ນ, ລາວໄດ້ວິເຄາະຫລາຍກວ່າ 6,000 ວັດທະນະ ທຳ ຂອງເຫັດຊະນິດຕ່າງໆ, ຈົນກວ່າລາວຈະໄດ້ຮັບຜົນດີ. ສານປະສົມທີ່ໄດ້ຮັບນັ້ນເອີ້ນວ່າ compactin. ສານນີ້ເຮັດໃຫ້ຄໍເລດເຕີຣອນຫຼຸດລົງໃນ ໝາ ແລະລີງ. ການສຶກສາເຫຼົ່ານີ້ໄດ້ດຶງດູດຄວາມສົນໃຈຂອງ Michael Brown ແລະ Joseph Goldstein ຂອງໂຮງຮຽນການແພດຂອງມະຫາວິທະຍາໄລ Texas Southwestern Medical. Brown ແລະ Goldstein, ພ້ອມດ້ວຍ Endo, ໄດ້ເລີ່ມຕົ້ນການສຶກສາຮ່ວມກັນແລະຢືນຢັນຂໍ້ມູນຂອງລາວ. ຜົນ ສຳ ເລັດທີ່ ສຳ ຄັນຂອງການທົດລອງທາງດ້ານການຊ່ວຍຄັ້ງ ທຳ ອິດແມ່ນກ່ຽວຂ້ອງກັບບໍລິສັດການຢາໃນການພັດທະນາຢາ ໃໝ່ ເຫຼົ່ານີ້. ທີ່ Merck, ທີມທີ່ ນຳ ພາໂດຍ Alfred Alberts ແລະ Roy Wagelos ໄດ້ເປີດຕົວການຄັດເລືອກວັດທະນະ ທຳ ໃໝ່ ຂອງເຫັດແລະ, ຈາກຜົນການວິເຄາະທັງ ໝົດ 18 ວັດທະນະ ທຳ, ໄດ້ຄົ້ນພົບອີກຢາທີ່ມີການເຄື່ອນໄຫວ. ສານ ໃໝ່ ເອີ້ນວ່າ lovastatin. ເຖິງຢ່າງໃດກໍ່ຕາມ, ໃນເວລາດຽວກັນ, ມັນໄດ້ຮັບການເຊື່ອກັນຢ່າງກວ້າງຂວາງວ່າການບໍລິຫານການໃຊ້ຢາທີ່ມີປະລິມານສູງ ສຳ ລັບ ໝາ ນ້ອຍ ນຳ ໄປສູ່ການພັດທະນາມະເລັງແລະການຄົ້ນຫາຢາ statins ໃໝ່ ໃນຊຸມປີ 1980. ໄດ້ຖືກໂຈະ. ເຖິງຢ່າງໃດກໍ່ຕາມ, ໃນເວລານັ້ນ, ຜົນປະໂຫຍດຂອງການໃຊ້ຢາ statins ເພື່ອປິ່ນປົວຄົນເຈັບທີ່ມີ hypercholesterolemia ໃນຄອບຄົວແມ່ນປາກົດຂື້ນແລ້ວ. ຫຼັງຈາກການປຶກສາຫາລືຫຼາຍຄັ້ງກັບຜູ້ຊ່ຽວຊານສາກົນແລະອົງການອາຫານແລະຢາ (FDA, ສະຫະລັດອາເມລິກາ), Merck ເລີ່ມພັດທະນາ lovastatin. ການສຶກສາຢ່າງກວ້າງຂວາງໃນສອງທົດສະວັດຕໍ່ໄປຍັງບໍ່ທັນໄດ້ເປີດເຜີຍຜົນກະທົບຂອງມະເລັງຂອງ lovastatin ແລະຢາຮຸ່ນ ໃໝ່ ທີ່ປາກົດຂື້ນຫຼັງຈາກມັນ.
ຊາວ. 1. ຢາ Statins ແມ່ນຕົວຍັບຍັ້ງຂອງ NM G-CoA reductase. ການປຽບທຽບໂຄງສ້າງຂອງ mevalonate ແລະຜະລິດຕະພັນການຢາ 4 ຊະນິດ (statins) ທີ່ຍັບຍັ້ງການກະ ທຳ ຂອງ NM G -CoA reductase.

Statins ຍັບຍັ້ງການກະ ທຳ ຂອງ HMG - CoA - reductase, mimicking ໂຄງສ້າງຂອງ mevalonate, ແລະເຮັດໃຫ້ສະກັດກັ້ນການສັງເຄາະຂອງ cholesterol. ໃນຄົນເຈັບທີ່ມີ hypercholesterolemia ເກີດມາຈາກຄວາມບົກຜ່ອງໃນຫນຶ່ງສໍາເນົາຂອງ LDL receptor gene, ເມື່ອກິນ lovastatin, ລະດັບ cholesterol ຈະຫຼຸດລົງ 30%. ຢາດັ່ງກ່າວຍິ່ງມີປະສິດທິພາບຍິ່ງໃນການປະສົມປະສານກັບຢາງໃສພິເສດທີ່ຜູກກົດອາຊິດບີແລະປ້ອງກັນການດູດຊືມຂອງມັນຈາກ ລຳ ໄສ້.
ໃນປະຈຸບັນ, ຢາ statins ແມ່ນມັກຖືກ ນຳ ໃຊ້ໃນການຫຼຸດໄຂມັນໃນ plasma cholesterol. ໃນເວລາທີ່ກິນຢາໃດໆ, ຄໍາຖາມທີ່ເກີດຂື້ນກ່ຽວກັບຜົນຂ້າງຄຽງທີ່ບໍ່ຕ້ອງການຂອງພວກເຂົາ. ຢ່າງໃດກໍ່ຕາມ, ໃນກໍລະນີຂອງຢາ statin, ຜົນຂ້າງຄຽງຫຼາຍຢ່າງ, ໃນທາງກົງກັນຂ້າມ, ມັນເປັນຜົນດີ. ຢາເຫຼົ່ານີ້ສາມາດກະຕຸ້ນການໄຫຼວຽນຂອງເລືອດ, ແກ້ໄຂແຜ່ນທີ່ມີຢູ່ແລ້ວທີ່ມີເສັ້ນເລືອດແດງທີ່ມີຢູ່ແລ້ວ (ເພື່ອບໍ່ໃຫ້ມັນແຕກອອກຈາກຝາຂອງເສັ້ນເລືອດແລະບໍ່ແຊກແຊງການໄຫຼວຽນຂອງເລືອດ), ຍັບຍັ້ງການລວບລວມຂອງ platelet, ແລະຍັງເຮັດໃຫ້ຂະບວນການອັກເສບໃນຝາຂອງເສັ້ນເລືອດອັກເສບອ່ອນແອລົງ. ໃນຜູ້ປ່ວຍທີ່ກິນຢາ statin ເປັນຄັ້ງ ທຳ ອິດ, ຜົນກະທົບເຫຼົ່ານີ້ຈະສະແດງອອກເຖິງແມ່ນວ່າກ່ອນທີ່ລະດັບຄໍເລສເຕີໂຣນຈະເລີ່ມຫຼຸດລົງ, ແລະມີສ່ວນກ່ຽວຂ້ອງກັບການຍັບຍັ້ງການສັງເຄາະ isoprenoid. ແນ່ນອນ, ບໍ່ແມ່ນຜົນຂ້າງຄຽງໃດໆຂອງຢາ statin ແມ່ນມີຜົນດີ. ໃນຜູ້ປ່ວຍບາງຄົນ (ໂດຍປົກກະຕິໃນບັນດາຜູ້ທີ່ກິນຢາ statin ໃນການປະສົມປະສານກັບຢາຊະນິດອື່ນທີ່ຊ່ວຍຫຼຸດຄໍເລສເຕີໂຣນ), ຄວາມເຈັບປວດກ້າມເນື້ອແລະກ້າມເນື້ອອ່ອນເພຍສາມາດເກີດຂື້ນໄດ້, ແລະບາງຄັ້ງກໍ່ເປັນແບບທີ່ແຂງແຮງພໍສົມຄວນ. ຜົນຂ້າງຄຽງອື່ນໆທີ່ຂ້ອນຂ້າງຫລາຍຂອງ statins ກໍ່ຖືກລົງທະບຽນ, ເຊິ່ງໂຊກດີ, ບໍ່ຄ່ອຍຈະເກີດຂື້ນ. ໃນຜູ້ປ່ວຍສ່ວນໃຫຍ່, ການກິນຢາ statin ສາມາດຍັບຍັ້ງການພັດທະນາຂອງພະຍາດ cardiovascular. ຄືກັນກັບຢາອື່ນໆ, ຢາ Statins ຄວນຈະຖືກ ນຳ ໃຊ້ເທົ່າທີ່ໄດ້ແນະ ນຳ ຈາກທ່ານ ໝໍ ຂອງທ່ານ.

ດ້ວຍການຂາດຂອງ HDL cholesterol ຕາມລະດັບ, ລະດັບ cholesterol ແມ່ນຕໍ່າຫຼາຍ, ໂດຍມີພະຍາດ Tangier, cholesterol ກໍ່ບໍ່ໄດ້ຖືກ ກຳ ນົດ. ຄວາມຜິດປົກກະຕິທາງພັນທຸ ກຳ ທັງສອງແມ່ນເກີດມາຈາກການກາຍພັນໃນໂປຣຕີນ ABC1. ແຕ່ລະສ່ວນຂອງໄຂມັນທີ່ບໍ່ມີ HDL ບໍ່ສາມາດຈັບເອົາຄໍເລດເຕີຣອນຈາກຈຸລັງທີ່ຂາດແຄນ ABC1, ແລະຈຸລັງທີ່ຫລຸດໄຂມັນໃນຄໍເລສເຕີຣອນຈະຖືກຍ້າຍອອກຈາກເລືອດຢ່າງໄວວາແລະຖືກ ທຳ ລາຍ. ທັງການຂາດເຊື້ອໄວຣັດຂອງໂຣກ HDL ແລະ Tangier ແມ່ນຫາຍາກທີ່ສຸດ (ມີ ໜ້ອຍ ກວ່າ 100 ຄອບຄົວທີ່ມີພະຍາດ Tangier ເປັນທີ່ຮູ້ຈັກທົ່ວໂລກ), ແຕ່ພະຍາດເຫຼົ່ານີ້ສະແດງໃຫ້ເຫັນເຖິງບົດບາດຂອງໂປຣຕີນ ABC1 ໃນການຄວບຄຸມລະດັບ plasma HDL. ເນື່ອງຈາກວ່າລະດັບ HDL ຂອງ Plasma ຕ່ ຳ ເຊື່ອມຕໍ່ກັບອັດຕາການ ທຳ ລາຍເສັ້ນເລືອດໃນເສັ້ນເລືອດສູງ, ທາດໂປຼຕີນຈາກ ABC1 ອາດຈະເປັນເປົ້າ ໝາຍ ທີ່ເປັນປະໂຫຍດ ສຳ ລັບຢາທີ່ອອກແບບມາເພື່ອຄວບຄຸມລະດັບ HDL. ■
ຮໍໂມນສະເຕີຣອຍຖືກສ້າງຕັ້ງຂື້ນໂດຍການແບ່ງປັນລະບົບຕ່ອງໂສ້ຂ້າງຂອງ cholesterol ແລະການຜຸພັງຂອງມັນ.
ບຸກຄົນໃດຫນຶ່ງໄດ້ຮັບທັງຫມົດຂອງຮໍໂມນສະເຕີຣອຍຂອງລາວຈາກ cholesterol (ຮູບ 21-45). ສອງຊັ້ນຂອງຮໍໂມນສະເຕີຣອຍຖືກສັງເຄາະໃນ cortex adrenal: ແຮ່ທາດແຮ່ທາດເຊິ່ງຄວບຄຸມການດູດຊຶມຂອງທາດອິນຊີທາດ (Na +, C l - ແລະ HC O) 3 -) ໃນ ໝາກ ໄຂ່ຫຼັງ, ແລະ glucocorticoids, ເຊິ່ງຊ່ວຍຄວບຄຸມ gluconeogenesis ແລະຫຼຸດຜ່ອນການຕອບສະ ໜອງ ອັກເສບ. ຮໍໂມນເພດຊາຍແມ່ນຜະລິດຢູ່ໃນຈຸລັງສືບພັນຂອງຜູ້ຊາຍແລະແມ່ຍິງແລະໃນແຮ່. ໃນນັ້ນ progesterone ເຊິ່ງຄວບຄຸມວົງຈອນການຈະເລີນພັນຂອງແມ່ຍິງ, androgens (ຕົວຢ່າງ: testosterone) ແລະ estrogens (estradiol), ເຊິ່ງມີຜົນກະທົບຕໍ່ການພັດທະນາຄຸນລັກສະນະທາງເພດຂັ້ນສອງໃນເພດຊາຍແລະເພດຍິງຕາມ ລຳ ດັບ. ຮໍໂມນສະເຕີຣອຍມີຜົນໃນລະດັບຄວາມເຂັ້ມຂຸ້ນທີ່ຕໍ່າຫຼາຍແລະດັ່ງນັ້ນຈິ່ງຖືກສັງເຄາະໃນປະລິມານທີ່ຂ້ອນຂ້າງ ໜ້ອຍ. ເມື່ອປຽບທຽບກັບເກືອນໍ້າບີ, cholesterol ທີ່ຂ້ອນຂ້າງແມ່ນບໍລິໂພກໃນການຜະລິດຮໍໂມນສະເຕີຣອຍ.

ຊາວ. -21-45.. ບາງຮໍໂມນສະເຕີຣອຍແມ່ນຖືກສ້າງຕັ້ງຂື້ນຈາກ cholesterol. ໂຄງສ້າງຂອງບາງສ່ວນຂອງທາດປະສົມເຫຼົ່ານີ້ແມ່ນສະແດງຢູ່ໃນຮູບ. 10-19, v .1.

ການສັງເຄາະຮໍໂມນສະເຕີຣອຍຮຽກຮ້ອງໃຫ້ມີການ ກຳ ຈັດປະລິມານກາກບອນຫຼາຍໆຫຼືທັງ ໝົດ ໃນ“ ຕ່ອງໂສ້ດ້ານຂ້າງ” ຂອງ C-17 D-ring ຂອງ cholesterol. ການໂຍກຍ້າຍລະບົບຕ່ອງໂສ້ຂ້າງຄຽງເກີດຂື້ນໃນ mitochondria ຂອງແພຈຸລັງ steroidogenic. ຂະບວນການໂຍກຍ້າຍປະກອບມີ hydroxylation ຂອງສອງປະລໍາມະນູກາກບອນທີ່ຢູ່ຕິດກັນຂອງລະບົບຕ່ອງໂສ້ດ້ານຂ້າງ (C-20 ແລະ C-22), ຫຼັງຈາກນັ້ນການຖີ້ມຄວາມຜູກພັນລະຫວ່າງພວກມັນ (ຮູບ 21-46). ການສ້າງຮໍໂມນຕ່າງໆຍັງປະກອບມີການແນະ ນຳ ຂອງອະຕອມອົກຊີເຈນ. ປະຕິກິລິຍາໄຮໂດຼລິກແລະການຜຸພັງທັງ ໝົດ ໃນໄລຍະການສະກັດກັ້ນ biosynthesis ແມ່ນຖືກກະຕຸ້ນໂດຍການຜຸພັງທີ່ມີ ໜ້າ ທີ່ປະສົມ (ເພີ່ມ 21-1) ທີ່ໃຊ້NА D PH, O 2 ແລະ mitochondrial cytochrome P-450.
ຊາວ. -4 21- .6. ການເຮັດຄວາມສະອາດຂອງຕ່ອງໂສ້ຂ້າງໃນການສັງເຄາະຮໍໂມນສະເຕີຣອຍ. ໃນລະບົບຜຸພັງນີ້ທີ່ມີ ໜ້າ ທີ່ປະສົມປະສານທີ່ oxidizes ປະລໍາມະນູກາກບອນທີ່ຢູ່ຕິດກັນ, cytochrome P-450 ເຮັດ ໜ້າ ທີ່ເປັນຕົວຄວບຄຸມເອເລັກໂຕຣນິກ. ມີສ່ວນຮ່ວມໃນຂະບວນການນີ້ແມ່ນໂປຣຕີນທີ່ມີການຂົນສົ່ງທາງເອເລັກໂຕຣນິກ, adrenodoxin ແລະ adrenodoxin reductase. ລະບົບຕ່ອງໂສ້ດ້ານຂ້າງຂອງລະບົບຕ່ອງໂສ້ດ້ານຂ້າງນີ້ຖືກພົບເຫັນຢູ່ໃນ mitochondria ຂອງ adrenal cortex, ບ່ອນທີ່ການຜະລິດ steroids ເຄື່ອນໄຫວເກີດຂື້ນ. Pregnenolone ແມ່ນສິ່ງທີ່ໃຫ້ຄວາມ ສຳ ຄັນກັບຮໍໂມນອື່ນໆທັງ ໝົດ (ຮູບ 21-45).

ຕົວກາງລະດັບ biosynthesis Cholesterol ແມ່ນມີສ່ວນກ່ຽວຂ້ອງກັບເສັ້ນທາງການຍ່ອຍອາຫານອື່ນໆ.
ນອກເຫນືອໄປຈາກບົດບາດຂອງມັນໃນລະດັບກາງຂອງ biosynthesis cholesterol, isopentenyl pyrophosphate ເຮັດຫນ້າທີ່ເປັນຕົວເຕືອນລ່ວງຫນ້າໃນການສັງເຄາະຂອງຈໍານວນມະຫາສານຂອງຊີວະມວນທີ່ປະຕິບັດຫນ້າທີ່ທາງຊີວະພາບຕ່າງໆ (ຮູບ 21-47). ສານເຫລົ່ານີ້ປະກອບມີວິຕາມິນ A, E ແລະ K, ເມັດສີຂອງພືດເຊັ່ນ carotene ແລະລະບົບຕ່ອງໂສ້ chlorophyll phytol, ຢາງ ທຳ ມະຊາດ, ນ້ ຳ ມັນທີ່ ຈຳ ເປັນຫຼາຍຢ່າງ (ຕົວຢ່າງເຊັ່ນ, ນ້ ຳ ມັນຫອມລະເຫີຍຂອງນ້ ຳ ມັນມະນາວ, ທາດຢູໂກຊີ, musk), ຮໍໂມນນ້ ຳ ແມງໄມ້ທີ່ຄວບຄຸມພະຍາດ metamorphosis, dolichols, ເຊິ່ງ ເຮັດ ໜ້າ ທີ່ເປັນຕົວຂົນສົ່ງລະລາຍໃນນໍ້າໃນການສັງເຄາະສະລັບສັບຊ້ອນຂອງ polysaccharides, ubiquinone ແລະ plastoquinone - ບໍລິສັດຂົນສົ່ງເອເລັກໂຕຣນິກໃນ mitochondria ແລະ chloroplasts. ໂມເລກຸນທັງ ໝົດ ນີ້ແມ່ນ isoprenoids ໃນໂຄງສ້າງ. ຫຼາຍກວ່າ 20,000 isoprenoids ທີ່ແຕກຕ່າງກັນໄດ້ຖືກພົບເຫັນໃນລັກສະນະ, ແລະຫຼາຍຮ້ອຍຄົນຂອງໃຫມ່ໄດ້ຖືກລາຍງານໃນແຕ່ລະປີ.
ຊາວ. 21-47. ຮູບພາບໂດຍລວມຂອງການ ກຳ ເນີດຊີວະພາບຂອງ isoprenoids. ໂຄງສ້າງຂອງຜະລິດຕະພັນສຸດທ້າຍທີ່ ນຳ ສະ ເໜີ ຢູ່ນີ້ແມ່ນໃຫ້ໃນ chap. 10 (v. 1).

Prenylation (ການຍຶດຕິດ covalent ຂອງ isoprenoid, ເບິ່ງຮູບທີ 27-35) ແມ່ນກົນໄກທົ່ວໄປທີ່ມີທາດໂປຼຕີນທີ່ສະມໍຢູ່ດ້ານໃນຂອງເຍື່ອຈຸລັງຂອງ mammalian (ເບິ່ງຮູບ 11-14). ໃນທາດໂປຼຕີນບາງຊະນິດ, lipid ທີ່ຖືກຜູກມັດແມ່ນຕົວແທນໂດຍກຸ່ມ farnesyl 15 ກາກບອນ, ໃນສ່ວນອື່ນໆມັນແມ່ນກຸ່ມ geranyl geranyl 20 ກາກບອນ. lipid ສອງຊະນິດນີ້ຕິດຢູ່ໃນເອນໄຊທີ່ແຕກຕ່າງກັນ. ມັນເປັນໄປໄດ້ວ່າປະຕິກິລິຍາ prenylation ທາດໂປຼຕີນໂດຍກົງຕໍ່ເຍື່ອທີ່ແຕກຕ່າງກັນໂດຍອີງຕາມທີ່ lipid ຕິດ. ການຍັບຍັ້ງການຂອງທາດໂປຼຕີນແມ່ນອີກບົດບາດ ສຳ ຄັນ ສຳ ລັບອະນຸພັນ isoprene - ຜູ້ເຂົ້າຮ່ວມໃນເສັ້ນທາງການເຜົາຜານໄຂມັນຂອງໄຂມັນ.
ບົດສະຫຼຸບຂອງພາກ 21.4 ການຊືມເຊື້ອທາງຊີວະພາບຂອງ Cholesterol, Steroids ແລະ Isoprenoids
Cholesterol ແມ່ນສ້າງຕັ້ງຂື້ນຈາກ acetyl-CoA ໃນປະຕິກິລິຍາສະລັບສັບຊ້ອນຜ່ານຕົວກາງເຊັ່ນ: hydro-hydroxy-β-methylglutaryl-CoA, mevalonate, ສອງ isoprene dimethylallyl pyrophosphate ແລະ isopentenyl pyrophosphate. ຂົ້ນຂອງຫົວ ໜ່ວຍ isoprene ຊ່ວຍໃຫ້ squalene ທີ່ບໍ່ແມ່ນຮອບວຽນ, ເຊິ່ງພັດທະນາເປັນລະບົບວົງແຫວນຂົ້ນແລະລະບົບຕ່ອງໂສ້ດ້ານຂ້າງ steroid.
■ການສັງເຄາະຂອງ cholesterol ແມ່ນຢູ່ພາຍໃຕ້ການຄວບຄຸມຮໍໂມນແລະນອກຈາກນັ້ນຍັງຖືກສະກັດກັ້ນໂດຍການເພີ່ມຄວາມເຂັ້ມຂົ້ນຂອງຄໍເລດເຕີລໍໃນຮ່າງກາຍ, ເຊິ່ງເກີດຂື້ນໂດຍຜ່ານການດັດແປງ covalent ແລະລະບຽບການຂອງການຖ່າຍທອດ.
est Cholesterol ແລະ esters cholesterol ແມ່ນຖືກປະຕິບັດໂດຍເລືອດຄື lipoproteins plasma. ແຕ່ສ່ວນ ໜຶ່ງ ຂອງ VLDL ໂອນເອົາ cholesterol, esters cholesterol ແລະ triacylglycerols ຈາກຕັບໄປສູ່ເນື້ອເຍື່ອອື່ນໆ, ເຊິ່ງທາດ triacylglycerols ຖືກເກັບຮັກສາໄວ້ໂດຍ lipoprotein lipase ແລະ VLDL ປ່ຽນເປັນ LDL. ສ່ວນປະກອບຂອງ LDL ທີ່ອຸດົມໄປດ້ວຍສານ cholesterol ແລະ cholesterol ແມ່ນຖືກຈັບໂດຍທາງອ້ອມໂດຍຕົວຮັບໂດຍ endocytosis, ໃນຂະນະທີ່ສານ apolipoprotein ໃນ B-100 ໃນ LDL ແມ່ນຖືກຮັບຮູ້ໂດຍຜູ້ຮັບເຍື່ອ plasma. HDL ເອົາ cholesterol ອອກຈາກເລືອດ, ໂອນມັນໄປສູ່ຕັບ. ສະພາບທາງໂພຊະນາການຫຼືຂໍ້ບົກຜ່ອງທາງພັນທຸ ກຳ ໃນການເຜົາຜານໄຂມັນໃນຄໍເລສເຕີໂຣນສາມາດ ນຳ ໄປສູ່ການເປັນໂຣກ atherosclerosis ແລະໂຣກ myocardial infarction.
hormones ຮໍໂມນສະເຕີຣອຍ (glucocorticoids, mineralocorticoids ແລະຮໍໂມນເພດຊາຍ) ແມ່ນສ້າງຕັ້ງຂື້ນຈາກຄໍເລສເຕີຣອນໂດຍການປ່ຽນລະບົບຕ່ອງໂສ້ດ້ານຂ້າງແລະແນະ ນຳ ອະຕອມອົກຊີເຈນເຂົ້າໃນລະບົບສະເຕີຣອຍຂອງແຫວນ. ທາດປະສົມ isoprenoid ອື່ນໆຫຼາຍຊະນິດແມ່ນຜະລິດມາຈາກ mevalonate ໂດຍການປະສົມທາດ isopentenyl pyrophosphate ແລະ dimethylallyl pyrophosphate ພ້ອມກັບ cholesterol.
ren ການລະລາຍຂອງໂປຣຕີນສະເພາະໃດ ໜຶ່ງ ເຮັດໃຫ້ພວກມັນຢູ່ໃນສະຖານທີ່ທີ່ມີການຜູກມັດຂອງຈຸລັງແລະມີຄວາມ ສຳ ຄັນຕໍ່ກິດຈະ ກຳ ທາງຊີວະພາບຂອງພວກມັນ.
ຄຳ ຖາມທີ 48. ລະບຽບການຂອງການເຜົາຜະຫລານອາຊິດໄຂມັນສູງ (ox ການຜຸພັງແລະຊີວະເຄມີ). ການສັງເຄາະ malonyl CoA. Carboxylase Acetyl CoA, ລະບຽບການຂອງກິດຈະ ກຳ ຂອງມັນ. ການຂົນສົ່ງຂອງ acyl Co-a ຜ່ານເຍື່ອພາຍໃນຂອງ mitochondria.
ຫລັກ
ປະລິມານຂອງ phenylalanine ແມ່ນບໍລິໂພກ
ໃນ 2 ວິທີ:
ເປີດ
ໃນກະຮອກ,
ຫັນ
ໃນ tyrosine.
ປ່ຽນເປັນສີ
phenylalanine ກັບ tyrosine ຕົ້ນຕໍ
ມີຄວາມຈໍາເປັນທີ່ຈະເອົາເກີນ
phenylalanine, ນັບຕັ້ງແຕ່ຄວາມເຂັ້ມຂົ້ນສູງ
ມັນເປັນພິດຕໍ່ຈຸລັງ. ການສຶກສາ
tyrosine ບໍ່ມີຄວາມ ໝາຍ ຫຍັງແທ້ໆ
ນັບຕັ້ງແຕ່ການຂາດຂອງອາຊິດ amino ນີ້
ໃນຈຸລັງທີ່ປະຕິບັດບໍ່ໄດ້ເກີດຂຶ້ນ.
ຫລັກ
metabolism metabolism ຈະເລີ່ມຕົ້ນ
ກັບ hydroxylation ຂອງມັນ (ຮູບ 9-29), ໃນ
ຜົນອອກມາໃນ tyrosine.
ຕິກິຣິຍານີ້ແມ່ນ catalyzed ໂດຍສະເພາະ
monooxy-nase - phenylalanine hydra (zsilase, ນ.
ເຊິ່ງເຮັດ ໜ້າ ທີ່ເປັນ coferment
tetrahydrobiopterin (N4BP).
ກິດຈະ ກຳ Enzyme ຍັງຂື້ນກັບ
ທີ່ປະທັບຂອງ Fe2.
ໃນ
ຕັບແມ່ນການເລັ່ງການລະດົມ
glycogen (ເບິ່ງພາກ 7). ເຖິງຢ່າງໃດກໍ່ຕາມຮຸ້ນ
glycogen ໃນຕັບຈະ ໝົດ ໄປ
18-24 ຊົ່ວໂມງຂອງການຖືສິນອົດເຂົ້າ. ແຫຼ່ງຕົ້ນຕໍ
ນ້ ຳ ຕານໃນຂະນະທີ່ຮຸ້ນ ໝົດ ໄປ
glycogen ກາຍເປັນ gluconeogenesis,
ເຊິ່ງເລີ່ມເລັ່ງ
ຊາວ.
ວັນທີ 11-29. ການປ່ຽນແປງທາງເດີນອາຫານຫຼັກ
ພະລັງງານໃນເວລາທີ່ການປ່ຽນແປງການດູດຊຶມ
ລັດ postabsorbent. CT
- ຮ່າງກາຍ ketone, FA - ກົດໄຂມັນ.
4-6 ບ
ຫຼັງຈາກອາຫານສຸດທ້າຍ. ສ່ວນຍ່ອຍ
glycerol ແມ່ນໃຊ້ ສຳ ລັບການສັງເຄາະນ້ ຳ ຕານ,
ອາຊິດ amino ແລະ lactate. ຢູ່ສູງ
ອັດຕາການສັງເຄາະຄວາມເຂັ້ມຂົ້ນຂອງ glucagon
ອາຊິດໄຂມັນຫຼຸດລົງເນື່ອງຈາກ
phosphorylation ແລະ inactivation
carboxylase acetyl CoA ແລະອັດຕາ
p-oxidation ເພີ່ມຂື້ນ. ເຖິງຢ່າງໃດກໍ່ຕາມ,
ການສະຫນອງໄຂມັນເພີ່ມຂຶ້ນກັບຕັບ
ອາຊິດທີ່ຖືກຂົນສົ່ງ
ຈາກບ່ອນໄຂມັນ. Acetyl-CoA ສ້າງຕັ້ງຂຶ້ນ
ໃນການຜຸພັງຂອງອາຊິດໄຂມັນ, ມັນຖືກນໍາໃຊ້
ໃນຕັບ ສຳ ລັບການສັງເຄາະຂອງອົງການ ketone.
ໃນ
ເນື້ອເຍື່ອ adipose ມີຄວາມເຂັ້ມຂົ້ນເພີ່ມຂື້ນ
glucagon ຫຼຸດຜ່ອນອັດຕາການສັງເຄາະ
TAG ແລະ lipolysis ແມ່ນກະຕຸ້ນ. ກະຕຸ້ນ
lipolysis - ຜົນໄດ້ຮັບການກະຕຸ້ນ
TAG lipase ທີ່ມີຄວາມອ່ອນໄຫວທາງຮໍໂມນ
adipocytes ພາຍໃຕ້ອິດທິພົນຂອງ glucagon.
ໄຂມັນກາຍເປັນສິ່ງ ສຳ ຄັນ
ແຫຼ່ງພະລັງງານໃນຕັບ, ກ້າມແລະ
ເນື້ອເຍື່ອ adipose.
ດັ່ງນັ້ນ
ດັ່ງນັ້ນ, ໃນໄລຍະເວລາ postabsorption
ຄວາມເຂັ້ມຂຸ້ນຂອງທາດນ້ ຳ ຕານໃນເລືອດຈະຮັກສາໄວ້
ໃນລະດັບຂອງ 80-100 mg / dl, ແລະລະດັບຂອງໄຂມັນ
ອາຊິດແລະຮ່າງກາຍ ketone ເພີ່ມຂື້ນ.
ນ້ ຳ ຕານ
ພະຍາດເບົາຫວານແມ່ນພະຍາດທີ່ເກີດຂື້ນ
ເນື່ອງຈາກຢ່າງແທ້ຈິງຫຼືພີ່ນ້ອງ
ການຂາດອິນຊູລິນ.
ກ.
ຮູບແບບທາງການແພດຕົ້ນຕໍຂອງນ້ ຳ ຕານ
ໂລກເບົາຫວານ
ອີງຕາມ
ອົງການຈັດຕັ້ງໂລກ
ພະຍາດເບົາຫວານດ້ານສຸຂະພາບ
ຈັດແບ່ງຕາມຄວາມແຕກຕ່າງ
ປັດໄຈທາງພັນທຸກໍາແລະທາງດ້ານການຊ່ວຍ
ສອງຮູບແບບຕົ້ນຕໍ: ພະຍາດເບົາຫວານ
ປະເພດ I - insulin-dependant (IDDM), ແລະໂລກເບົາຫວານ
ປະເພດ II - ເອກະລາດບໍ່ແມ່ນອິນຊູລິນ (NIDDM).
ລະບຽບການ
ການສັງເຄາະຂອງ zhk
ການສັງເຄາະຂອງ lcd - acetyl CoA carboxylase.
enzyme ນີ້ແມ່ນລະບຽບໂດຍຫຼາຍ
ທາງ.
ການກະຕຸ້ນ / ການແບ່ງແຍກ
ສະລັບສັບຊ້ອນ enzyme subunit. ໃນ
ແບບຟອມການເຄື່ອນໄຫວຂອງ acetyl CoA carboxylase
ເປັນຕົວແທນສະລັບສັບຊ້ອນແຍກຕ່າງຫາກ,
ແຕ່ລະພາກສ່ວນປະກອບດ້ວຍ 4 ສ່ວນຍ່ອຍ.
ຜູ້ກະຕຸ້ນຂອງເອນໄຊແມ່ນ citrate. ມັນກະຕຸ້ນ
ປະສົມປະສານຂອງສະລັບສັບຊ້ອນ, ເປັນຜົນມາຈາກການ
ໃນຂະນະທີ່ກິດຈະ ກຳ ຂອງເອນໄຊເພີ່ມຂື້ນ
. Inhibitor-palmitoyl-CoA. ລາວຮຽກຮ້ອງ
dissociation ສະລັບສັບຊ້ອນແລະການຫຼຸດລົງ
ກິດຈະກໍາ enzyme.
Phosphorylation / Dephosphorylation
carboxylase acetyl CoA. ໃນ
ລັດ postabsorption ຫຼືໃນ
ການເຮັດວຽກທາງດ້ານຮ່າງກາຍ glucagonized
adrenaline ຜ່ານ adenylate cyclase
ລະບົບຖືກເປີດໃຊ້ໂດຍ prokinase A ແລະ
ກະຕຸ້ນ phosphorylation subunit
carboxylase acetyl CoA. Phosphorylated
enzyme ແມ່ນບໍ່ມີປະໂຫຍດແລະການສັງເຄາະໄຂມັນ
ອາຊິດຢຸດ.
ດູດຊືມ
insulin ໄລຍະເວລາກະຕຸ້ນ phosphatase,
ແລະ carboxylase acetyl-CoA ເຂົ້າໄປໃນ
dephosphorylated ລັດ. ຈາກນັ້ນ
ພາຍໃຕ້ອິດທິພົນຂອງ citrate ເກີດຂື້ນ
polymerization ຂອງ protomers ຂອງ enzyme ໄດ້, ແລະ
ເຂົາກາຍເປັນການເຄື່ອນໄຫວ. ນອກເຫນືອໄປຈາກການກະຕຸ້ນ
enzyme, citrate ປະຕິບັດການອື່ນ
ເຮັດວຽກໃນການສັງເຄາະຂອງ LCD. ດູດຊືມ
ໄລຍະເວລາໃນ mitochondria ຂອງຈຸລັງຕັບ
ສະສົມ citrate, ໃນນັ້ນ
ສານຕົກຄ້າງ acyl ຖືກຂົນສົ່ງໄປ
cytosol.
ລະບຽບການ
ອັດຕາການຜຸພັງ.
ເສັ້ນທາງ ox-oxidation-metabolism.
ເຊື່ອມໂຍງຢ່າງ ແໜ້ນ ແຟ້ນກັບວຽກງານຂອງ CPE ແລະທົ່ວໄປ
ວິທີການຂອງ catabolism. ເພາະສະນັ້ນຄວາມໄວຂອງມັນ
ຄວບຄຸມໂດຍຄວາມຕ້ອງການຂອງຫ້ອງ
ພະລັງງານ i.e. ໂດຍອັດຕາສ່ວນຂອງ ATP / ADP ແລະ NADH / NAD, ເຊັ່ນດຽວກັນກັບອັດຕາການປະຕິກິລິຍາຂອງ CPE ແລະ
ເສັ້ນທາງທົ່ວໄປຂອງ catabolism. ຄວາມໄວ
ການຜຸພັງ in ໃນເນື້ອເຍື່ອຂຶ້ນກັບຄວາມພ້ອມ
ອະນຸພາກ, i.e.
ກ່ຽວກັບຈໍານວນເງິນຂອງໄຂມັນ
ກົດເຂົ້າໃນ mitochondria.
ຄວາມເຂັ້ມຂົ້ນຂອງອາຊິດໄຂມັນຟຣີ
ໃນເລືອດສູງເຖີງການກະຕຸ້ນ
lipolysis ໃນເນື້ອເຍື່ອ adipose ໃນເວລາຖືສິນອົດເຂົ້າ
ພາຍໃຕ້ອິດທິພົນຂອງ glucagon ແລະໃນລະຫວ່າງການອອກ ກຳ ລັງກາຍ
ເຮັດວຽກພາຍໃຕ້ອິດທິພົນຂອງ adrenaline. ໃນເຫຼົ່ານີ້
ອາຊິດໄຂມັນກາຍເປັນ
ແຫຼ່ງພະລັງງານຕົ້ນຕໍ
ສໍາລັບກ້າມແລະຕັບ, ເປັນຜົນມາຈາກການ
ການຜຸພັງ are ແມ່ນຖືກສ້າງຕັ້ງຂື້ນໂດຍ NADH ແລະທາດຍັບຍັ້ງການ acetyl-CoA
pyruvate dehydrogenase ສັບຊ້ອນ.
ການຫັນປ່ຽນຮູບແບບ pyruvate
ຈາກ glucose ກັບ acetyl-CoA ຊ້າລົງ.
ທາດແປ້ງໃນລະດັບປານກາງສະສົມ
glycolysis ແລະໂດຍສະເພາະ, glucose-6-phosphate.
Glucose-6-phosphate ຍັບຍັ້ງການ hexokinase
ແລະເພາະສະນັ້ນຈຶ່ງທໍ້ຖອຍໃຈ
ການ ນຳ ໃຊ້ນ້ ຳ ຕານໃນຂະບວນການ
glycolysis. ເພາະສະນັ້ນ, ລວມ
ການ ນຳ ໃຊ້ lcd ເປັນແຫລ່ງຫຼັກ
ພະລັງງານໃນເນື້ອເຍື່ອກ້າມເນື້ອແລະຕັບ
ຊ່ວຍປະຢັດນ້ ຳ ຕານ ສຳ ລັບເນື້ອເຍື່ອເສັ້ນປະສາດແລະ
ເມັດເລືອດແດງ.
ອັດຕາການຜຸພັງເຊັ່ນກັນ
ຂື້ນກັບກິດຈະ ກຳ ຂອງເອນໄຊ
carnitine acyltransferases ຂ້າພະເຈົ້າ.
ໃນຕັບ, enzyme ນີ້ຖືກຍັບຍັ້ງ.
malonyl CoA, ສານທີ່ຖືກສ້າງຕັ້ງຂື້ນ
ດ້ວຍ biosynthesis ຂອງ lcd. ໃນໄລຍະເວລາທີ່ດູດຊຶມ
glycolysis ຖືກກະຕຸ້ນຢູ່ໃນຕັບແລະ
ການສ້າງຕັ້ງຂອງ acetyl-CoA ເພີ່ມຂື້ນ
ຈາກ pyruvate. ປະຕິກິລິຍາການສັງເຄາະ ທຳ ອິດ
ການປ່ຽນເປັນ lcd ຂອງ acetyl-CoA ກັບ malonyl-CoA.
Malonyl-CoA ຍັບຍັ້ງການຜຸພັງຂອງ lcd,
ເຊິ່ງສາມາດໃຊ້ ສຳ ລັບການສັງເຄາະ
ໄຂມັນ.
ການສຶກສາ
malonyl-CoA ຈາກ acetyl-CoA-regulatory
ຕິກິລິຍາໃນ biosynthesis lcd. ປະຕິກິລິຍາ ທຳ ອິດ
ການປ່ຽນແປງການສັງເຄາະ lcd ຂອງ acetyl-CoA ເພື່ອ
malonyl CoA. enzyme ທາດໂປຼຕິນ
ປະຕິກິລິຍານີ້ (acetyl Coa carboxylase),
ເປັນຂອງຫ້ອງຮຽນຂອງເສັ້ນ ໄໝ. ລາວມີ
biotin ຜູກພັນ covalently. ໃນຄັ້ງ ທຳ ອິດ
co2ent ໄລຍະປະຕິກິລິຍາ
ຜູກກັບ biotin ເນື່ອງຈາກພະລັງງານ
ATP, ໃນຂັ້ນຕອນທີ 2 COO- ຖືກຍົກຍ້າຍ
ກ່ຽວກັບ acetyl-CoA ເພື່ອປະກອບເປັນ malonyl-CoA.
ກິດຈະ ກຳ Enzyme Acetyl CoA Carboxylase
ກຳ ນົດຄວາມໄວຂອງການຕິດຕໍ່ທັງ ໝົດ
ປະຕິກິລິຍາການສັງເຄາະ lc
citrate ກະຕຸ້ນເອນໄຊໃນ cytosol
carboxylase acetyl CoA. Malonyl CoA ໃນ
ແລະເຮັດໃຫ້ການໂອນຍ້າຍທີ່ສູງຂຶ້ນ
ອາຊິດໄຂມັນຈາກ cytosol ກັບມາຕຣິກເບື້ອງ
mitochondria ກິດຈະກໍາຍັບຍັ້ງ
ສານເຄມີທີ່ຢູ່ນອກ CoA: carnitine acyltransferase,
ດັ່ງນັ້ນການປິດການຜຸພັງຂອງທີ່ສູງກວ່າ
ອາຊິດໄຂມັນ.
Acetyl-CoA Oxaloacetate Ac
HS-CoA Citrate

HSCOA ATP Citrate → Acetyl-CoA ADP Pi Oxaloacetate
Acetyl-CoA
ໃນ cytoplasm ເຮັດຫນ້າທີ່ເປັນຊັ້ນຍ່ອຍເລີ່ມຕົ້ນ
ໃນການສັງເຄາະ lcd, ແລະ oxaloacetate ໃນ
cytosol ຜ່ານການຫັນປ່ຽນໃນ
ຜົນຂອງການທີ່ pyruvate ຖືກສ້າງຕັ້ງຂຶ້ນ.
Biosynthesis Cholesterol
biosynthesis Cholesterol ແມ່ນເກີດຂື້ນໃນ endicasmic reticulum. ແຫລ່ງທີ່ມາຂອງອະຕອມຄາບອນທັງ ໝົດ ໃນໂມເລກຸນແມ່ນ acetyl-SCoA, ເຊິ່ງມາຈາກ mitochondria ນີ້ເປັນສ່ວນ ໜຶ່ງ ຂອງທາດ citrate, ຄືກັບການສັງເຄາະຂອງກົດໄຂມັນ. ການໃຊ້ຊີວະເຄມີພັນທຸ ກຳ ມັນໃຊ້ໂມເລກຸນ 18 ATP ແລະໂມເລກຸນ 13 NADPH.
ການສ້າງຄໍເລດເຕີຣອນເກີດຂື້ນໃນຫຼາຍກວ່າ 30 ປະຕິກິລິຍາເຊິ່ງສາມາດຈັດກຸ່ມເປັນຫຼາຍໄລຍະ.
1. ການສັງເຄາະຂອງອາຊິດ mevalonic.
ປະຕິກິລິຍາການສັງເຄາະສອງຄັ້ງ ທຳ ອິດແມ່ນກົງກັບປະຕິກິລິຍາ ketogenesis, ແຕ່ວ່າຫຼັງຈາກການສັງເຄາະ 3-hydroxy-3-methylglutaryl-ScoA, ທາດ enzyme ເຂົ້າສູ່ hydroxymethyl-glutaryl-ScoA reductase (HMG-SCOA reductase), ປະກອບເປັນກົດ mevalonic.
 |